用Cr3+掺杂的氮化铝是理想的LED用荧光粉基质材料 氮化铝(其晶胞如图所示)可由氯化铝与氨经气相反
用Cr3+掺杂的氮化铝是理想的LED用荧光粉基质材料,氮化铝(其晶胞如图所示)可由氯化铝与氨经气相反应制得。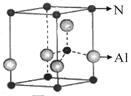 (1)Cr3+基态的核外电子排布式可表示为 。 (2)氮化铝的化学式为 。 (3)氯化铝易升华,其双聚物Al2Cl6结构如图所示。在Al2Cl6中存在的化学键有 (填字母)。  a.离子键 b.共价键 c.配位键 d.金属键 (4)一定条件下用Al2O3和CCl4反应制备AlCl3的反应为:Al2O3+3CCl4=2AlCl3+3COCl2。其中,COCl2分子的空间构型为 。一种与CCl4互为等电子体的离子的化学式为 。 (5)AlCl3在下述反应中作催化剂。分子③中碳原子的杂化类型为 。  |
参考解答
| (1)1s22s22p63s23p63d3或[Ar3d3(2分) (2)AlN(2分) (3)bc(2分) (4)平面三角形(2分) SO42-或PO43-或ClO4-或SiO44-或PCl4+(2分) (5)sp2和sp3(2分) |
试题分析:(2)氮原子在晶胞的顶点和内部,共有8×1/8+1=2;铝原子在晶胞的棱上和内部,共有4×1/4+1=2;化学式为AlN;(3)氯最外层有7个电子已形成1个共用电子对达到8电子的稳定结构,中间的氯与铝原子形成了2个共价键,故其中之一为配位键,由氯原子提供孤电子对,铝原子提供空轨道形成配位键;(4)COCl2分子中碳原子的价电子对数为(4+2)÷2=3,为sp2杂化,又有3个配位原子故为平面三角形;等电子体(原子数同,价电子数同)有SO42-或PO43-或ClO4-或SiO44-或PCl4+;(5)分子③中碳原子中形成双键的为sp2杂化,全形成单键的为sp3杂化。 |
相似问题
铜 铁 钒都是日常生活中常见的金属 具有广泛用途。请回答:(1)在元素周期表中 铜元素位于____区
铜、铁、钒都是日常生活中常见的金属,具有广泛用途。请回答:(1)在元素周期表中,铜元素位于____区,其基态原子的电子排布式为。(2)Cu2O的熔点比Cu2
已知周期表中 元素Q R W Y与元素X相邻。Y的最高化台价氧化物的水化物是强酸。回答下列问题: (
已知周期表中,元素Q、R、W、Y与元素X相邻。Y的最高化台价氧化物的水化物是强酸。回答下列问题: (1)W与Q可以形成一种高温结构陶瓷材料。W的氯化物分
已知A B C D E F G为前四周期七种元素且原子序数依次增大 其中A的基态原子中没有成对电子;
已知A、B、C、D、E、F、G为前四周期七种元素且原子序数依次增大,其中A的基态原子中没有成对电子;B的基态原子中电子占据三种能量不同的原子轨道,且每种
[物质结构与性质]已知:A B C D E F六种元素 原子序数依次增大。A原子核外有两种形状的电子
[物质结构与性质]已知:A、B、C、D、E、F六种元素,原子序数依次增大。A原子核外有两种形状的电子云,两种形状的电子云轨道上电子数相等;B是短周期中原
已知A B C D E五种元素的原子序数依次增大 其中A原子所处的周期数 族序数都与其原子序数相等;
已知A、B、C、D、E五种元素的原子序数依次增大,其中A原子所处的周期数、族序数都与其原子序数相等;B原子核外电子有6种不同的运动状态;D原子L电子层上有2












