铜 铁 钒都是日常生活中常见的金属 具有广泛用途。请回答:(1)在元素周期表中 铜元素位于____区
| 铜、铁、钒都是日常生活中常见的金属,具有广泛用途。请回答: (1)在元素周期表中,铜元素位于____区,其基态原子的电子排布式为 。 (2)Cu2O的熔点比Cu2S高,原因为 。 (3)Fe(CO)5是一种常见的配合物,可代替四乙基铅作为汽油的抗爆震剂。 ①写出CO的一种常见等电子体分子的结构式____;两者相比较沸点高的为 (填分子式)。 ②Fe(CO)5在一定条件下发生反应:Fe(CO)5(s)=Fe(s)+5CO(g),已知:反应过程中,断裂的化学键只有配位键,由此判断该反应所形成的化学键类型为 。 (4)已知AlCl3·NH3和AlCl4—中均有配位键。AlCl3·NH3中,提供空轨道的原于是____;在AlCl4中Al原子的杂化轨道类型为 。 (5)金属铝的晶胞结构如图甲所示,原子之间相对位置关系的平面图如图乙所示。则晶体铝中原子的堆积方式为____。已知:铝原子半径为d cm,摩尔质量为M g·mol-1,阿伏加德罗常数的值为NA,则晶体铝的密度ρ= 。 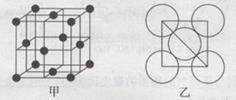 |
参考解答
| (1)ds 1s22 s22p63 s23 p63d104s1或[Ar3d104s1 (2)Cu2O与Cu2S相比较,其阳离子相同、阴离子所带的电荷也相同,但由于氧离子的半径小于硫离子的离子半径,Cu2O的晶格能更大(或亚铜离子与氧离子形成的离子键强于亚铜离子与硫离子形成的离子键),所以Cu2O的熔点比Cu2S的高。 (3)N≡N CO 金属键 (4)Al sp3 (5)面心立方最密堆积 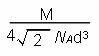 g/cm3 g/cm3 |
试题分析:(1)29号元素Cu在元素周期表中位于第四周期第IB族。因此属于ds区。其基态原子的电子排布式为1s22 s22p63 s23 p63d104s1或[Ar3d104s1。(2)Cu2O的熔点比Cu2S高,是因为Cu2O与Cu2S都属于离子晶体。其阳离子相同、阴离子所带的电荷也相同,但由于氧离子的半径小于硫离子的离子半径,Cu2O的晶格能更大,断裂其离子键需要消耗的能量更高,所以Cu2O的熔点比Cu2S的高。(3) ①CO的一种常见等电子体是N2。分子的结构式N≡N。CO与N2两者相对分子质量相同。但由于CO分子为极性分子,增加了分子之间的相互作用,使得克服分子间作用力使物质熔化或汽化消耗的能量高。因此二者相比较沸点高的为CO。②该反应所形成的化学键类型为金属键。(4)在AlCl3·NH3中,提供空轨道的原于是Al,提供孤对电子的是N原子。在AlCl4中Al原子的杂化轨道类型为sp3。(5)由晶体结构示意图可看出晶体铝中原子的堆积方式为面心立方最密堆积。每个晶胞中含有的Al原子的个数为:8×1/8+6×1/2=4.设晶胞的边长为a,则  ; ;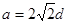 。则晶胞的密度为: 。则晶胞的密度为: 。整理可得密度ρ= 。整理可得密度ρ=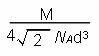 g/cm3。 g/cm3。 |
相似问题
已知周期表中 元素Q R W Y与元素X相邻。Y的最高化台价氧化物的水化物是强酸。回答下列问题: (
已知周期表中,元素Q、R、W、Y与元素X相邻。Y的最高化台价氧化物的水化物是强酸。回答下列问题: (1)W与Q可以形成一种高温结构陶瓷材料。W的氯化物分
已知A B C D E F G为前四周期七种元素且原子序数依次增大 其中A的基态原子中没有成对电子;
已知A、B、C、D、E、F、G为前四周期七种元素且原子序数依次增大,其中A的基态原子中没有成对电子;B的基态原子中电子占据三种能量不同的原子轨道,且每种
[物质结构与性质]已知:A B C D E F六种元素 原子序数依次增大。A原子核外有两种形状的电子
[物质结构与性质]已知:A、B、C、D、E、F六种元素,原子序数依次增大。A原子核外有两种形状的电子云,两种形状的电子云轨道上电子数相等;B是短周期中原
已知A B C D E五种元素的原子序数依次增大 其中A原子所处的周期数 族序数都与其原子序数相等;
已知A、B、C、D、E五种元素的原子序数依次增大,其中A原子所处的周期数、族序数都与其原子序数相等;B原子核外电子有6种不同的运动状态;D原子L电子层上有2
下表为长式周期表的一部分 其中的编号代表对应的元素。(1)元素③基态原子的电子排布式为
下表为长式周期表的一部分,其中的编号代表对应的元素。(1)元素③基态原子的电子排布式为。(2)②与⑦形成的化合物的空间构型为。(3)元素②④⑤⑥的












