下表为长式周期表的一部分 其中的编号代表对应的元素。(1)元素③基态原子的电子排布式为
下表为长式周期表的一部分,其中的编号代表对应的元素。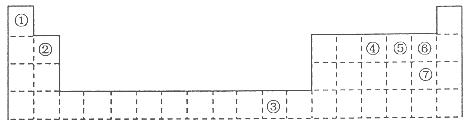 (1)元素③基态原子的电子排布式为 。 (2)②与⑦形成的化合物的空间构型为 。 (3)元素②④⑤⑥的第一电离能由大到小的顺序是 (填元素符号) (4)在测定①与⑥形成化合物的相对分子质量时,实验测得的值一般高于理论值的主要原因 。 (5)胆矾CuSO4·5H2O可写成[Cu(H2O)4]SO4·H2O,其结构如图所示。下列说法正确的是 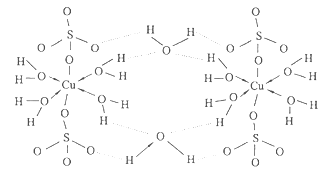 a.在上述结构示意图中,所有氧原子都采用sp3杂化 b.在上述结构示意图中,存在配位键、共价键和离子键 c.胆矾是分子晶体,分子间存在氢键 d.胆矾中的水在不同温度下会分步失去 (6)往硫酸铜溶液中加入过量氨水,可生成[Cu(NH3)4]2+配离子。已知NF3与NH3的空间构型都是三角锥形,但NF3不易与Cu2+形成配离子,其原因是 。 |
参考解答
| (1)1s22s22p63s23p63d104s1; (2)直线型; (3)F>N>O>Be; (4)因为HF分子在气相时会通过氢键二聚或多聚,导致实测相对分子质量偏大; (5)bd; (6)N、F、H三种元素的电负性:F>N>H,在NF3中,共用电子对偏向F,偏离N原子使得氮原子上的孤对电子难于与Cu2+形成配位键。 |
试题分析:根据元素周期表的结构及常见元素在元素周期表中的位置判断,①为氢元素,②为铍元素,③为铜元素,④为氮元素,⑤为氧元素,⑥为氟元素,⑦为氯元素。(1)元素③为铜元素,基态原子的电子排布式为1s22s22p63s23p63d104s1;(2)根据价层电子对互斥理论判断,②与⑦形成的化合物BeCl2的空间构型为直线型;(3)根据同周期元素性质递变规律判断:同周期由左向右第一电离能呈递增趋势,但氮元素原子最外层p轨道为半充满状态,较稳定,第一电离能比相邻的氧元素大,元素②④⑤⑥的第一电离能由大到小的顺序是F>N>O>Be;(4)在测定①与⑥形成化合物HF的相对分子质量时,实验测得的值一般高于理论值的主要原因是因为HF分子在气相时会通过氢键二聚或多聚,导致实测相对分子质量偏大;(5)a.由题给结构判断,只有H2O中的氧原子和SO42—中的2个羟基氧为饱和氧原子,采用sp3杂化,错误;b.在上述结构示意图中,存在配位键、共价键和离子键,正确;c.胆矾是离子晶体,错误;d.胆矾中的水在不同温度下会分步失去,正确,选bd;(6)往硫酸铜溶液中加入过量氨水,可生成[Cu(NH3)42+配离子。已知NF3与NH3的空间构型都是三角锥形,但NF3不易与Cu2+形成配离子,其原因是N、F、H三种元素的电负性:F>N>H,在NF3中,共用电子对偏向F,偏离N原子使得氮原子上的孤对电子难于与Cu2+形成配位键。 |
相似问题
粉煤灰是燃煤电厂的工业废渣 其中含莫来石(Al6Si2O13)的质量分数为38% 还有含量较多的Si
粉煤灰是燃煤电厂的工业废渣,其中含莫来石(Al6Si2O13)的质量分数为38%,还有含量较多的SiO2。用粉煤灰和纯碱在高温下烧结,可制取NaAlSiO4,有关化学反
现有aA bB cC dD eE gG六种短周期元素 a+b=c a+c=d a+d=e d+e=g
现有aA、bB、cC、dD、eE、gG六种短周期元素,a+b=c,a+c=d,a+d=e,d+e=g,B、C、E、G的单质均有多种同素异形体,请回答下列问题:Ⅰ.(1)C、D、E元素
下列关于化合价的判断正确的是 [ ]A.Na2O中O元素为-1价
下列关于化合价的判断正确的是 [ ]A Na2O中O元素为-1价B Na2O2中O元素为-2价 C SO2中O元素为-1价D SO3中O元素为-2价
下列各组物质各自形成的晶体 均属于分子晶体的化合物的是( )。A.NH3 HD C10H8
下列各组物质各自形成的晶体,均属于分子晶体的化合物的是()。A.NH3、HD、C10H8B.PCl3、CO2、H2SO4C.SO2、SiO2、P2O5D.CCl4、Na2S、H2O2
现有1——20号元素A B C D所对应的物质的性质或微粒结构如下表:元素物质性质或微粒结构AM层上
现有1——20号元素A、B、C、D所对应的物质的性质或微粒结构如下表:元素物质性质或微粒结构AM层上有2对成对电子BB的离子与D的离子具有相同电子层结构,且












