锆(Zr)是一种重要的稀有元素。(1)由锆英石(ZrSiO4)可制取ZrOC12-8H2O①用碳熔炼
| 锆(Zr)是一种重要的稀有元素。 (1)由锆英石(ZrSiO4)可制取ZrOC12-8H2O ①用碳熔炼锆英石制碳化锆的化学方程式为:ZrSiO4+3C  ZrC+SiO2+2CO↑,该反应中氧化剂与还原剂的质量比为 。 ZrC+SiO2+2CO↑,该反应中氧化剂与还原剂的质量比为 。②用烧碱熔ZrC制取Na2ZrO3,完成该反应的化学方程式: □ZrC+□NaOH+□ 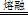 □Na2ZrO3+□CO2+□H2O □Na2ZrO3+□CO2+□H2O③碱熔料用盐酸浸出可得ZrOC12溶液。通过蒸发结晶从该溶液中获得ZrOC12-8H2O,还需用浓盐酸控制酸度,原因是 。 (2)ZrOC12-8H2O具有多方面的用途。用ZrOC12-8H2O和YC13制备Y2O3--ZrO2复合粉体的流程如下: 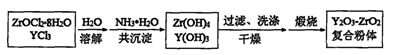 ①共沉淀时,生成Zr(OH)4的化学方程式为 。 ②当共沉淀恰好完全时,溶液中c(Zr4+)= 。 (已知Ksp[Zr(OH)4]=6.4×10—49,Ksp[Y(OH)3]=8.0×10—23;溶液中离子浓度为1×10-5mol?L-1时,可认为沉淀完全) ③将制得的一种复合粉体溶于水后,测得其微粒的平均直径为30 nm,该分散系属于 。 |
参考解答
(15分)(1)①1∶2(2分) ②ZrC+2NaOH+2O2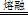 Na2ZrO3+CO2+H2O(3分) Na2ZrO3+CO2+H2O(3分)③防止ZrO2+的水解(2分) (2)①ZrOCl2+2NH3?H2O+H2O=Zr(OH)4↓+2NH4Cl(3分) ②4.0×10—26mol?L—1(3分) ③胶体(2分) |
试题分析:(1)①碳元素的化合价既升高又降低,C既是氧化剂又是还原剂,ZrC是还原产物,CO是氧化产物,且还原产物与氧化产物的物质的量之比为1∶2,则氧化剂与还原剂的物质的量或质量之比为1∶2;②碳元素由—4价升为+4价,被氧气氧化,氧元素由0价降为—2价,根据化合价升降总数相等、原子守恒配平可得,ZrC+2NaOH+2O2 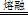 Na2ZrO3+CO2+H2O;③用盐酸酸浸、控制酸度的主要目的是抑制盐类的水解或防止ZrO2+的水解;(2)①读图可知,共沉淀发生复分解反应,则反应式为ZrOCl2+2NH3?H2O+H2O=Zr(OH)4↓+2NH4Cl;②当Y3+沉淀完全时,由Y(OH)3(s) Na2ZrO3+CO2+H2O;③用盐酸酸浸、控制酸度的主要目的是抑制盐类的水解或防止ZrO2+的水解;(2)①读图可知,共沉淀发生复分解反应,则反应式为ZrOCl2+2NH3?H2O+H2O=Zr(OH)4↓+2NH4Cl;②当Y3+沉淀完全时,由Y(OH)3(s) Y3+(aq)+3OH—(aq)可知,c(OH—)= Y3+(aq)+3OH—(aq)可知,c(OH—)=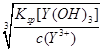 = =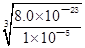 =2.0×10—6mol?L—1,由Zr(OH)4(s) =2.0×10—6mol?L—1,由Zr(OH)4(s) Zr4+(aq)+4OH—(aq)可知,c(Zr4+)= Zr4+(aq)+4OH—(aq)可知,c(Zr4+)=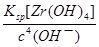 = =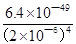 mol?L—1=4.0×10—26mol?L—1;③1nm<30nm<100nm,则该分散系属于胶体。 mol?L—1=4.0×10—26mol?L—1;③1nm<30nm<100nm,则该分散系属于胶体。 |
相似问题
(12分) 实验室可由软锰矿(主要成分为 MnO2)制备 KMnO4 方法如下:软锰矿与过量固体 K
(12分) 实验室可由软锰矿(主要成分为 MnO2)制备 KMnO4,方法如下:软锰矿与过量固体 KOH 和 KClO3在高温下反应,生成锰酸钾(K2MnO4)和 KCl;用水
本题分子量用以下数据:H2O18.0 CaO56.0 CaO272.0。过氧化钙是一种安全无毒的氧化
本题分子量用以下数据:H2O18 0,CaO56 0,CaO272 0。过氧化钙是一种安全无毒的氧化物,通常含有部分CaO,且带有数量不等的结晶水。为分析某过氧化钙样品
(11分)Ⅰ (1)高锰酸钾是一种典型的强氧化剂。(1)在用KMnO4酸性溶液处理Cu2S和CuS的
(11分)Ⅰ、(1)高锰酸钾是一种典型的强氧化剂。(1)在用KMnO4酸性溶液处理Cu2S和CuS的混合物时,发生的反应如下: Ⅰ MnO4-+ Cu2S + H+→ Cu2+
某反应中反应物与生成物有:AsH3 H2SO4 KBrO3 K2SO4 H3AsO4 H2O和一种未
某反应中反应物与生成物有:AsH3、H2SO4、KBrO3、K2SO4、H3AsO4、H2O和一种未知物质X。(1)己知KBrO3在反应中得到电子,则该反应的还原剂是____________
(10分)氢气还原氧化铜所得的红色固体可能是铜与氧化亚铜的混合物 已知Cu2O在酸性溶液中可发生自身
(10分)氢气还原氧化铜所得的红色固体可能是铜与氧化亚铜的混合物,已知Cu2O在酸性溶液中可发生自身氧化还原反应,生成Cu2+和单质铜。(1)检验氧化铜被












