某反应中反应物与生成物有:AsH3 H2SO4 KBrO3 K2SO4 H3AsO4 H2O和一种未
| 某反应中反应物与生成物有:AsH3、H2SO4、KBrO3、K2SO4、H3AsO4、H2O和一种未知物质X。 (1)己知KBrO3在反应中得到电子,则该反应的还原剂是_____________。 (2)已知0.2mol KBrO3在反应中得到1 mol电子生成X,则X的化学式为_____________。 (3)将氧化剂和还原剂的化学式及其配平后的系数填入下列方框中,井标出电子转移的方向和数目: 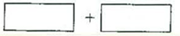 (4)溶液的酸碱性对氧化还原反应的方向有密切的关系。对于反应:AsO33-+I2+2OH-  AsO43-+2I-+ 2H2O,在较强酸性时,上述氧化还原反应向____进行(填:“正反应”或“逆反应”);强碱性时,是否有利H3As3还原I2?为什么?_______________________________________。 AsO43-+2I-+ 2H2O,在较强酸性时,上述氧化还原反应向____进行(填:“正反应”或“逆反应”);强碱性时,是否有利H3As3还原I2?为什么?_______________________________________。 |
参考解答
(本题共8分)(1)AsH3(2分) (2)Br2(2分) (3) (2分) (2分)(4)逆反应,不利,碱性过强I2发生歧化。(2分) |
试题分析:(1)KBrO3在反应中得到电子,则Br元素的化合价降低。在所给出的物质中AsH3具有还原性,As元素的化合价在反应中升高,所以该反应的还原剂是AsH3。 (2)设X中Br元素化合价为x,由元素化合价的变化可知转移的电子为0.2mol×(5-x)=1mol,解得x=0,即还原产物X为Br2。 (3)KBrO3在反应中得到电子,Br元素的化合价从+5价降低到0价,得到5个电子。AsH3在反应中失去电子,As元素的化合价从-3价升高到+5价,失去8个电子,所以根据电子得失守恒可知氧化剂与还原剂的物质的量之比是8:5,因此转移的电子数为40e-,则相应电子转移的方向和数目为  。 。(4)根据方程式AsO33-+I2+2OH-  AsO43-+2I-+2H2O可知,在强酸性时,氢离子和氢氧根离子反应,氢氧根离子浓度降低,所以平衡向逆反应方向移动;在强碱性时,碘易发生歧化反应,所以不利于H3As3还原I2。 AsO43-+2I-+2H2O可知,在强酸性时,氢离子和氢氧根离子反应,氢氧根离子浓度降低,所以平衡向逆反应方向移动;在强碱性时,碘易发生歧化反应,所以不利于H3As3还原I2。 |
相似问题
(10分)氢气还原氧化铜所得的红色固体可能是铜与氧化亚铜的混合物 已知Cu2O在酸性溶液中可发生自身
(10分)氢气还原氧化铜所得的红色固体可能是铜与氧化亚铜的混合物,已知Cu2O在酸性溶液中可发生自身氧化还原反应,生成Cu2+和单质铜。(1)检验氧化铜被
已知Fe3O4可表示成(FeO·Fe2O3) 水热法制备Fe3O4纳米颗粒的总反应为:3Fe2++2
已知Fe3O4可表示成(FeO·Fe2O3),水热法制备Fe3O4纳米颗粒的总反应为:3Fe2++2S2O+O2+4OH-=Fe3O4+S4O+2H2O,下列说法正确的是()A.O2和S2O是氧化剂
氧化还原反应的实质是A.氧元素的得与失B.化合价的升降C.电子的得失或偏移D.分子中原子重新组合
氧化还原反应的实质是A.氧元素的得与失B.化合价的升降C.电子的得失或偏移D.分子中原子重新组合
用双线桥表示下列反应中得失电子的情况 并按要求回答:3FeO + 10HNO3= 3Fe(NO3)3
用双线桥表示下列反应中得失电子的情况,并按要求回答:3FeO + 10HNO3= 3Fe(NO3)3+ NO↑ + 5H2O.(1)氧化剂是;氧化产物是。(2)在参加反应的
G W X Y Z均为含氯的化合物 我们不了解它们的化学式 但知道它们在一定条件下具有如下的转化关系
G、W、X、Y、Z均为含氯的化合物,我们不了解它们的化学式,但知道它们在一定条件下具有如下的转化关系(未配平):①G→W+NaCl②W+H2OX+H2③Y+NaOH→G+W+












