(11分)Ⅰ (1)高锰酸钾是一种典型的强氧化剂。(1)在用KMnO4酸性溶液处理Cu2S和CuS的
| (11分)Ⅰ、(1)高锰酸钾是一种典型的强氧化剂。 (1)在用KMnO4酸性溶液处理Cu2S和CuS的混合物时,发生的反应如下: Ⅰ. MnO4-+ Cu2S + H+→ Cu2+ + SO2↑ + Mn2+ + H2O(未配平) Ⅱ. MnO4-+ CuS + H+ → Cu2+ + SO2↑ + Mn2+ + H2O(未配平) 请回答下列问题: ①下列关于反应Ⅰ的说法不正确的是 。
②用单线桥表示反应Ⅱ中电子转移的数目和方向: MnO4-+ CuS (2)在稀硫酸中,MnO4-和H2O2也能发生氧化还原反应: 氧化反应: H2O2 - 2e-==2H++O2↑ 还原反应: MnO4-+5e-+ 8H+===Mn2++4H2O 写出该氧化还原反应的化学方程式: 。 反应中若有0.5 mol H2O2参加此反应,转移电子的个数为 。由上述反应得出的氧化性强弱的结论是 。 ②实验中发现,当加入的少量KMnO4完全反应后,H2O2仍能发生反应放出气体。其可能的原因是: 。 |
参考解答
(11分)(1)① BE (2分)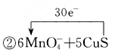 (2分) (2分)(2)①5H2O2+2KMnO4+3H2SO4==2MnSO4+5O2↑+K2SO4+8H2O (2分) 6.02×1023(1分)氧化性: KMnO4> H2O2(O2)(2分) ②生成的Mn2+对H2O2分解具有催化作用(2分) |
| (1)①根据反应的方程式可知,铜元素的化合价从+1价升高到+2价,硫元素的化合价从-2价升高到+4价,所以1molCu2S失去8mol电子。而锰元素的化合价从+7价降低到+2价,得到5个电子,所以根据电子得失守恒可知,氧化剂与还原剂的物质的量之比为8∶5。由于在氧化还原反应中,氧化剂的氧化性强于氧化产物的,所以氧化性应该是 MnO4-> Cu2+> Mn2+,因此选项BE是错误的,其余选项都是正确的,答案选BE。 ②根据反应的方程式可知,硫元素的化合价从-2价升高到+4价,所以1molCu2S失去6mol电子,所以用单线桥表示反应Ⅱ中电子转移的数目和方向是  。 。(2)①根据已知的氧化反应和还原反应可知,该反应的方程式是 5H2O2+2KMnO4+3H2SO4==2MnSO4+5O2↑+K2SO4+8H2O;根据氧元素的化合价变化可知,双氧水中氧元素从-1价升高到0价,所以1mol双氧水生成2nol电子,则0.5mol双氧水转移电子的个数是6.02×1023个;由于在氧化还原反应中,氧化剂的氧化性强于氧化产物的,所以氧化性强弱顺序应该是KMnO4> H2O2(O2)。 ②加入的少量KMnO4完全反应后,H2O2仍能发生反应放出气体,这说明反应中生成的Mn2+对H2O2分解具有催化作用。 |
相似问题
某反应中反应物与生成物有:AsH3 H2SO4 KBrO3 K2SO4 H3AsO4 H2O和一种未
某反应中反应物与生成物有:AsH3、H2SO4、KBrO3、K2SO4、H3AsO4、H2O和一种未知物质X。(1)己知KBrO3在反应中得到电子,则该反应的还原剂是____________
(10分)氢气还原氧化铜所得的红色固体可能是铜与氧化亚铜的混合物 已知Cu2O在酸性溶液中可发生自身
(10分)氢气还原氧化铜所得的红色固体可能是铜与氧化亚铜的混合物,已知Cu2O在酸性溶液中可发生自身氧化还原反应,生成Cu2+和单质铜。(1)检验氧化铜被
已知Fe3O4可表示成(FeO·Fe2O3) 水热法制备Fe3O4纳米颗粒的总反应为:3Fe2++2
已知Fe3O4可表示成(FeO·Fe2O3),水热法制备Fe3O4纳米颗粒的总反应为:3Fe2++2S2O+O2+4OH-=Fe3O4+S4O+2H2O,下列说法正确的是()A.O2和S2O是氧化剂
氧化还原反应的实质是A.氧元素的得与失B.化合价的升降C.电子的得失或偏移D.分子中原子重新组合
氧化还原反应的实质是A.氧元素的得与失B.化合价的升降C.电子的得失或偏移D.分子中原子重新组合
用双线桥表示下列反应中得失电子的情况 并按要求回答:3FeO + 10HNO3= 3Fe(NO3)3
用双线桥表示下列反应中得失电子的情况,并按要求回答:3FeO + 10HNO3= 3Fe(NO3)3+ NO↑ + 5H2O.(1)氧化剂是;氧化产物是。(2)在参加反应的












