本题分子量用以下数据:H2O18.0 CaO56.0 CaO272.0。过氧化钙是一种安全无毒的氧化
| 本题分子量用以下数据:H2O18.0,CaO56.0,CaO272.0。 过氧化钙是一种安全无毒的氧化物,通常含有部分CaO,且带有数量不等的结晶水。为分析某过氧化钙样品的组成进行了如下实验。 ①称取0.270g样品,灼热使之完全分解,生成CaO、O2和H2O,得到的O2在标准状况下体积为33.6mL。 ②另取0.120g样品,溶于稀盐酸,加热煮沸,使生成的H2O2完全分解。然后将溶液中的Ca2+完全转化成CaC2O4沉淀,经过滤洗涤后,将沉淀溶于热的稀硫酸,用0.0200mol·L-1KMnO4溶液滴定,共用去31.0mLKMnO4溶液。化学方程式如下: 5CaC2O4+2KMnO4+8H2SO4==K2SO4+2MnSO4+5CaSO4+10CO2↑+8H2O (1)写出CaO2受热分解的化学方程式。 (2)计算样品中CaO2的质量分数。 (3)计算样品中CaO2·xH2O的x值。 |
参考解答
(1)2CaO2 2CaO+O2↑ 2CaO+O2↑(2) 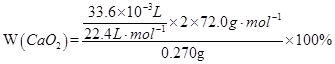 =80.0% =80.0%(3)n(CaC2O4)=n(Ca2+)=31.0×10-3L×0.0200mol·L-1 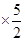 =0.00155mol =0.00155mol其中CaO2所含的n(Ca2+)= 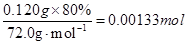 m(CaO)=(0.00155mol-0.00133mol)×56.0g·mol-1=0.012g m(H2O)=0.120g-0.120g×80.0%-0.012g=0.012g 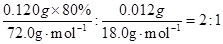 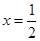 |
【错解分析】第(1)问:①CaO2==CaO+O2,②CaO2==Ca+O2,③2CaO2+H2O==2CaO+O2+H2O,④2CaO2·nH2O==2CaO+O2+2nH2O(n=1,2,3……即定值)。 第(2)问:①40%,②62%,③[ 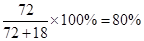 。来源: 。来源:第(3)问:①(72+18x):0.120=1:(1.55×10-3),②72∶M(CaO2·xH2O)=80%,M=90,x=1。 【正解】第(1)问:根据信息①,可写出CaO2受热分解的化学方程式: 2CaO2  CaO+O2↑。常见①误区,是由于未配平所致。②误区是由于未读懂题示信息所致。③误区是由于多写了水的分子式所致。④误区是由于未通观全题的叙述,误将CaO2·xH2O写成有定值的水,造成失误。第(2)问:根据信息①中,O2在标准状况下的体积可求出的物质的量为33.6mL÷22400mL·mol-1=1.50×10-3mol。 CaO+O2↑。常见①误区,是由于未配平所致。②误区是由于未读懂题示信息所致。③误区是由于多写了水的分子式所致。④误区是由于未通观全题的叙述,误将CaO2·xH2O写成有定值的水,造成失误。第(2)问:根据信息①中,O2在标准状况下的体积可求出的物质的量为33.6mL÷22400mL·mol-1=1.50×10-3mol。根据关系式2CaO2~O2,可求得CaO2物质的量为2×1.50×10-3mol,CaO2质量为2×1.50×10-3mol×72.0g·mol-1 样品中CaO2的质量分数为: 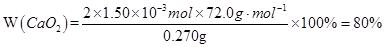 出现①误区,是由于化学方程式未配平,关系式未找对(CaO2~O2),导致失误。出现②误区,是由于误将CaO2的摩尔质量72.0g·mol-1用CaO的摩尔质量56.0g·mol-1代入式中计算,导致失误。出现③误区,是由于未用题中数据,直接用CaO2·H2O的摩尔质量进行求算,虽然计算结果都是80%,但计算的依据错误。 第(3)问:根据信息②,可求出CaC2O4物质的量(即Ca2+总物质的量),所用关系式为: 5CaC2O4~2KMnO4 KMnO4的物质的量为0.0200mol·L-1×31.0mL×10-3L·mL-1·CaC2O4的物质的量为0.0200mol·L-1×31.0×10-3L×5/2=0.00155mol 其中CaO2所含Ca2+的物质的量为: n(Ca2+)= 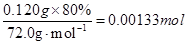 CaO的物质的量为0.00155mol-0.00133mol m(CaO)=(0.00155mol-0.00133mol)×56.0g·mol-1 =0.012g m(H2O)=0.120g-0.120g×80.0%-0.012g=0.012g CaO2与H2O的物质的量之比为 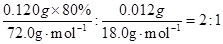 故 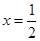 出现①误区,是由于错误列式: CaO2·xH2O~CaC2O4~xH2O (72+18x)g 1mol 0.120g 1.55×10-3mol 误将0.120g全部看成CaO2·xH2O,忽略了样品中“通常含有部分CaO”,CaO2·xH2O~CaC2O4这个关系式也是错的,CaC2O4的物质的量是溶液中全部Ca2+的物质的量,它不等于CaO2中所含的Ca2+的物质的量。 出现②误区,是由于误将样品中CaO2的质量分数(80%)作为结晶水合物中含CaO2的质量分数,进行推算,导致失误。 |
相似问题
(11分)Ⅰ (1)高锰酸钾是一种典型的强氧化剂。(1)在用KMnO4酸性溶液处理Cu2S和CuS的
(11分)Ⅰ、(1)高锰酸钾是一种典型的强氧化剂。(1)在用KMnO4酸性溶液处理Cu2S和CuS的混合物时,发生的反应如下: Ⅰ MnO4-+ Cu2S + H+→ Cu2+
某反应中反应物与生成物有:AsH3 H2SO4 KBrO3 K2SO4 H3AsO4 H2O和一种未
某反应中反应物与生成物有:AsH3、H2SO4、KBrO3、K2SO4、H3AsO4、H2O和一种未知物质X。(1)己知KBrO3在反应中得到电子,则该反应的还原剂是____________
(10分)氢气还原氧化铜所得的红色固体可能是铜与氧化亚铜的混合物 已知Cu2O在酸性溶液中可发生自身
(10分)氢气还原氧化铜所得的红色固体可能是铜与氧化亚铜的混合物,已知Cu2O在酸性溶液中可发生自身氧化还原反应,生成Cu2+和单质铜。(1)检验氧化铜被
已知Fe3O4可表示成(FeO·Fe2O3) 水热法制备Fe3O4纳米颗粒的总反应为:3Fe2++2
已知Fe3O4可表示成(FeO·Fe2O3),水热法制备Fe3O4纳米颗粒的总反应为:3Fe2++2S2O+O2+4OH-=Fe3O4+S4O+2H2O,下列说法正确的是()A.O2和S2O是氧化剂
氧化还原反应的实质是A.氧元素的得与失B.化合价的升降C.电子的得失或偏移D.分子中原子重新组合
氧化还原反应的实质是A.氧元素的得与失B.化合价的升降C.电子的得失或偏移D.分子中原子重新组合












