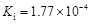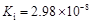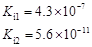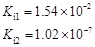部分弱酸的电离平衡常数如下表:弱酸HCOOHHClOH2CO3H2SO3电离平衡常数(25℃) (1
部分弱酸的电离平衡常数如下表:
(1)在温度相同时,各弱酸的Ki值与酸性的相对强弱的关系为:________________________。 (2)下列离子方程式正确的是 A.2ClO- + H2O + CO2 → 2HClO + CO32- B.2HCOOH + CO32- → 2HCOO- + H2O + CO2↑ C.H2SO3 + 2HCOO- → 2HCOOH + SO32- D.Cl2 + H2O+2CO32- → 2HCO3- + Cl- + ClO- (3)常温下,pH=3的HCOOH溶液与pH=11的NaOH溶液等体积混合后,溶液中离子浓度由大到小的顺序为 。 亚硒酸(H2SeO3)也是一种二元弱酸,常温下是一种无色固体,易溶于水,有较强的氧化性。 (4)往亚硒酸溶液中不断通入SO2会产生红褐色单质,写出该反应的化学方程式: 。 (5)将亚硒酸与30%的H2O2加热可制得硒酸(H2SeO4),反应方程式如下: H2SeO3 + H2O2 → H2SeO4+H2O,下列说法中正确的是…………………………………( ) A.H2O2既是氧化剂又是还原剂 B.H2O 既不是氧化产物又不是还原产物 C.H2SeO4既是氧化产物又是还原产物 D.氧化性:H2SeO3>H2SeO4 碲酸(H6TeO6)是一种很弱的酸, 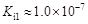 ,但它的氧化性比硫酸还要强。在酸性介质中,碲酸可将HI氧化成I2,方程式如下: ,但它的氧化性比硫酸还要强。在酸性介质中,碲酸可将HI氧化成I2,方程式如下:HI+ H6TeO6 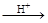 TeO2+ Te+ I2+ H2O TeO2+ Te+ I2+ H2O(6)若反应中生成的TeO2与Te的物质的量之比为 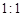 ,试配平上述化学方程式。 ,试配平上述化学方程式。 |
参考解答
| (1)Ki值越大,酸性越强 (2分,合理给分) (2)BD (2分) (3)C(HCOO—)>C(Na+)>C(H+)>C(OH—) (2分) (4)H2SeO3 + 2SO2 +H2O → Se ↓+ 2H2SO4 (2分) (5)C (2分) (6)8HI + 2H6TeO6 → TeO2 + Te +4I2 + 10H2O (2分) |
试题分析:(1)在温度相同时,各弱酸的Ki值与酸性的相对强弱的关系为.Ki值越大,表示电离出氢离子的程度越大,则酸性越强。 (2)根据电离平衡常数可知A正确的是ClO- + H2O + CO2 → HClO + HCO3-,错误。B正确。C.H2SO3 + HCOO- → HCOOH + HSO3- ,错误。D.Cl2 + H2O+2CO32- → 2HCO3- + Cl- + ClO-,正确。 (3)常温下,pH=3的HCOOH溶液与pH=11的NaOH溶液等体积混合后,生成HCOONa,由于甲酸是弱酸相当于有剩余,故混和液呈酸性,HCOOH电离程度大于甲酸根的水解程度,故溶液中离子浓度由大到小的顺序为C(HCOO—)>C(Na+)>C(H+)>C(OH—)。 (4)由信息:亚硒酸(H2SeO3)有较强的氧化性。SO2具有还原性,会产生红褐色单质应该是硒单质,则该反应的化学方程式:H2SeO3 + 2SO2 +H2O → Se ↓+ 2H2SO4。 (5)将亚硒酸与30%的H2O2加热可制得硒酸(H2SeO4),此时过氧化氢做氧化剂,则H2SeO4既是氧化产物又是还原产物。 (6)根据化合价升降法和题目中的信息:TeO2与Te的物质的量之比为 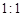 ,配平方程式为8HI + 2H6TeO6 → TeO2 + Te +4I2 + 10H2O。 ,配平方程式为8HI + 2H6TeO6 → TeO2 + Te +4I2 + 10H2O。 |
相似问题
铁元素的化合价有+2 +3两种 磁铁矿的主要成分是Fe3O4 能与盐酸反应生成两种盐。(1)请用铁的
铁元素的化合价有+2、+3两种,磁铁矿的主要成分是Fe3O4,能与盐酸反应生成两种盐。(1)请用铁的+2价、+3价铁元素的化合价有+2、+3两种,磁铁矿的
KClO3和浓HCl在一定温度下反应会生成黄绿色的易爆物二氧化氯。其反应可表述为: KClO3+
KClO3和浓HCl在一定温度下反应会生成黄绿色的易爆物二氧化氯。其反应可表述为:KClO3+HCl(浓)=KCl+ClO2+Cl2+H2O(1)配平以上化学方程式(化学计量数填入
(1)写出硫酸铁在水溶液中电离的电离方程式 (2
(1)写出硫酸铁在水溶液中电离的电离方程式(2)用双线桥法,标出下列氧化还原反应的电子转移方向和电子总数2FeCl3+Fe=3FeCl2氧化剂是(填化学式)(3)
维生素C又称“抗坏血酸” 在人体内有重要的功能。例如 能帮助人体将食物中不易吸收的Fe3+转变为易吸
维生素C又称“抗坏血酸”,在人体内有重要的功能。例如,能帮助人体将食物中不易吸收的Fe3+转变为易吸收的Fe2+,这说明维生素C具有________(填“氧化性”
由于NaNO2有毒 将含该物质的废水直接排放会引起水体的严重污染 所以这种废水必须经处理后才能排放。
由于NaNO2有毒,将含该物质的废水直接排放会引起水体的严重污染,所以这种废水必须经处理后才能排放。处理方法之一的原理如下:(1)请完成并配平该化学方