由于NaNO2有毒 将含该物质的废水直接排放会引起水体的严重污染 所以这种废水必须经处理后才能排放。
由于NaNO2有毒,将含该物质的废水直接排放会引起水体的严重污染,所以这种废水必须经处理后才能排放。处理方法之一的原理如下: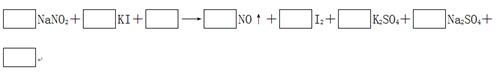 (1)请完成并配平该化学方程式。 (2)在上述反应中,若要生成50.8 g I2,则电子转移了________个。 (3)用上述反应来处理NaNO2并不是最佳方法,其原因是 ________________________________________________________________________。 从环保角度来讲,要处理NaNO2,所用物质的________(填“还原性”或“氧化性”)应该比KI更______(填“强”或“弱”)。 |
参考解答
(1)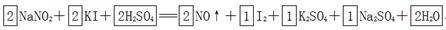 (2)2.408×1023(或0. 4NA) (3)反应生成了NO,该物质会造成大气污染;还原性;强 |
试题分析:(1)根据方程式可知,碘化钾中碘元素的化合价从-1价升高到0价,失去1个电子,做还原剂。亚硝酸钠中氮元素的化合价从+3价降低到+2价,得到1个电子,做氧化剂。则根据电子守恒可知氧化剂和和还原剂的物质的量之比时1:1。根据原子守恒可知,反应物中还有硫酸生成,生成物还有水生成,则反应的化学方程式是2NaNO2+2KI+2H2SO4=2NO↑+I2+K2SO4+Na2SO4+2H2O。 (2)50.8g单质碘的物质的量是50.8g÷254g/mol=0.2mol,所以转移电子的物质的量是0.2mol×2=0.4mol,个数是0.4NA。 (3)由于反应生成了NO,该物质会造成大气污染,所以该方法不是最佳方法。从环保角度来讲,要处理NaNO2,所用物质的还原性应该比KI更强。 点评:该题是基础性试题的考查,主要是考查学生对氧化还原反应的判断、配平以及计算的了解掌握情况。该题的关键是准确标出有关元素的化合价变化情况,然后结合题意和电子得失守恒灵活运用即可,难度不大。 |
相似问题
水是生命之源 也是化学反应中的主角。请回答下列问题:I.水是一种电解质 发生电离会产生电子总数相同的
水是生命之源,也是化学反应中的主角。请回答下列问题:I.水是一种电解质,发生电离会产生电子总数相同的两种微粒,其电离方程式为。Ⅱ.在许多反应中H2
已知NH4CuSO3与足量的1mol/L硫酸溶液混合微热 产生下列现象:①有红色金属生成;②有刺激性
已知NH4CuSO3与足量的1mol L硫酸溶液混合微热,产生下列现象:①有红色金属生成;②有刺激性气味气体产生;③溶液呈蓝色,据此判断下列说法合理的是A.NH
下列反应一定不属于氧化还原反应的是( )A.化合反应B.分解反应C.置换反应D.复分解反应
下列反应一定不属于氧化还原反应的是()A.化合反应B.分解反应C.置换反应D.复分解反应
对于反应3Cl2+6NaOH5NaCl+NaClO3+3H2O 以下叙述正确的是A.Cl2是氧化剂
对于反应3Cl2+6NaOH5NaCl+NaClO3+3H2O,以下叙述正确的是A.Cl2是氧化剂,NaOH是还原剂B.氧化剂失电子数与还原剂得电子数之比为1∶1C.NaCl是氧化产物D
金属铈(稀土元素)性质活泼。铈常见的化合价为+3和+4 氧化性:Ce4+>Fe3+>I2。下列说法正
金属铈(稀土元素)性质活泼。铈常见的化合价为+3和+4,氧化性:Ce4+>Fe3+>I2。下列说法正确的是A.铈溶于氢碘酸的化学方程式可表示为:Ce + 4HI =












