有a b c d f五种前四周期元素 原子序数依次增大 a b c三种元素的基态原子具有相同的能层和
| 有a、b、c、d、f五种前四周期元素,原子序数依次增大,a、b、c三种元素的基态原子具有相同的能层和能级,第一电离能I1(a)<I1(c)<I1(b)且其中基态b原子的2p轨道处半充满状态,已知bc2+与ac2互为等电子体,d为周期表前四周期中电负性最小的元素,f的原子序数为29。请回答下列问题。(如需表示具体元素请用相应的元素符号) (1)写出bc2+的电子式__________,基态f原子的核外电子排布式为___________。 (2)b的简单氢化物极易溶于c的简单氢化物,其主要原因是 。 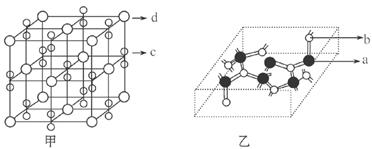 (3)化合物甲由c、d两种元素组成,其晶胞如甲图,甲的化学式___________。 (4)化合物乙的部分结构如乙图,乙由a、b两元素组成,硬度超过金刚石。①乙的晶体类型为________________________,其硬度超过金刚石的原因是_________________________。 ②乙的晶体中a、b两种元素原子的杂化方式均为___________________。 |
参考解答
(1)[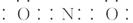 ]+ 1s22s22p63s23p63d104s1 ]+ 1s22s22p63s23p63d104s1 (2)两种氢化物都是极性分子,分子间都能形成氢键 (3)KO2 (4)①原子晶体 C—N键的键长小于C—C键,C—N键的键能大于C—C键 ②sp3杂化 |
试题分析:基态b原子的2p轨道处半充满状态,则b原子的电子排布为1s22s22p3,b元素为N元素,a、b、c三种元素的基态原子具有相同的能层和能级,第一电离能I1(a)<I1(c)<I1(b),bc2+与ac2互为等电子体,说明b原子电子数比a原子数多1个,则a为C元素,c为O元素,d为周期表前四周期中电负性最小的元素,则d为K元素,f的原子序数为29,则f为Cu元素。 (1)bc2+为NO2+,与ac2即CO2互为等电子体,所以N原子分别与O原子形成双键,所以bc2+电子式为:[ 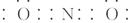 ]+;Cu原子核外电子数为29,所以核外电子排布式为:1s22s22p63s23p63d104s1 ]+;Cu原子核外电子数为29,所以核外电子排布式为:1s22s22p63s23p63d104s1(2)b的简单氢化物极易溶于c的简单氢化物,即NH3极易溶于H2O,是因为NH3与H2O都是极性分子,分子间都能形成氢键。 (3)根据甲的晶胞示意图可以看出K位于8个顶点和6个面的面心,所以1个晶胞含K:8×1/8+6×1/2=4,两个O原子形成的原子团位于晶胞的12个棱的中心和体心,则数目为:12×1/4+1=4,所以甲的化学式为:KO2 (4)①因为乙的硬度超过金刚石,所以乙的晶体类型为原子晶体;乙是由C、N两元素组成,晶体内共价键为C—N键,金刚石内共价键为C—C键,因为C—N键的键长小于C—C键,C—N键的键能大于C—C键,所以硬度超过金刚石。 ②因为乙晶体结构类似金刚石,C、N原子都形成4个共价键,所以C、N原子的杂化方式均为sp3杂化。 |
相似问题
第4周期元素由于受3d能级电子的影响 性质的递变规律与短周期元素略有不同。Ⅰ.第4周期元素的第一电离
第4周期元素由于受3d能级电子的影响,性质的递变规律与短周期元素略有不同。Ⅰ 第4周期元素的第一电离能随原子序数的增大,总趋势是逐渐增大的。镓(31Ga)的
利用15N可以测定亚硝酸盐对地下水质的污染情况。(1)下列说法正确的是________。A.14N与
利用15N可以测定亚硝酸盐对地下水质的污染情况。(1)下列说法正确的是________。A.14N与15N为同种核素B.14N的第一电离能小于14CC.15NH3与14NH3均能形成
A B C D E为前四周期元素 原子序数依次增大。基态A原子的核外电子占据4个原子轨道;B与C同主
A、B、C、D、E为前四周期元素,原子序数依次增大。基态A原子的核外电子占据4个原子轨道;B与C同主族,大气平流层中单质B3浓度减少会致人患皮肤癌增加;D
下列判断正确的是( )A.根据同周期元素的第一电离能变化趋势 推出Al的第一电离能比Mg大B.根据
下列判断正确的是( )A.根据同周期元素的第一电离能变化趋势,推出Al的第一电离能比Mg大B.根据主族元素最高正化合价与族序数的关系,推出卤族元素最
2010年上海世博会场馆 大量的照明材料或屏幕都使用了发光二极管(LED)。目前市售LED品片 材质
2010年上海世博会场馆,大量的照明材料或屏幕都使用了发光二极管(LED)。目前市售LED品片,材质基本以GaAs(砷化镓)、AlGaInP(磷化铝镓铟)、lnGaN(












