利用15N可以测定亚硝酸盐对地下水质的污染情况。(1)下列说法正确的是________。A.14N与
| 利用15N可以测定亚硝酸盐对地下水质的污染情况。 (1)下列说法正确的是________。
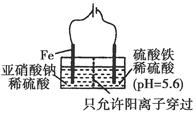 (3)工业上电解法处理亚硝酸盐的模拟工艺如图。已知阳极区发生化学反应: 2NO2—+8H++6Fe2+=N2↑+6Fe3++4H2O ①阳极电极反应方程式是________(不考虑后续反应); ②若硫酸溶液浓度过大,阴极区会有气体逸出,该气体为_______ (填化学式);该现象表明c(H+)越大,H+氧化性越________; ③若电解时电路中有0.6 mol电子转移,且NaNO2有剩余,则电解池中生成Na2SO4________mol。 |
参考解答
| (1)CD (2) 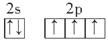 8 sp3杂化 8 sp3杂化(3)①Fe-2e-=Fe2+ ②H2 强 ③0.05 |
| (1)A项,质子数相同而中子数不同的核素互为同位素;B项,N的价电子层为半充满结构,更加稳定;C项,含有N元素,故能形成氢键;D项,二者结构相似,分子组成相差一个“CH2”。(3)③由电极反应知转移0.6 mol电子时生成Fe2+ 0.3 mol,故消耗NaNO2 0.1 mol,根据钠元素守恒可知生成Na2SO4 0.05 mol。 点拨:本题考查电化学,考查考生对电极反应的掌握情况。难度中等。 |
相似问题
A B C D E为前四周期元素 原子序数依次增大。基态A原子的核外电子占据4个原子轨道;B与C同主
A、B、C、D、E为前四周期元素,原子序数依次增大。基态A原子的核外电子占据4个原子轨道;B与C同主族,大气平流层中单质B3浓度减少会致人患皮肤癌增加;D
下列判断正确的是( )A.根据同周期元素的第一电离能变化趋势 推出Al的第一电离能比Mg大B.根据
下列判断正确的是( )A.根据同周期元素的第一电离能变化趋势,推出Al的第一电离能比Mg大B.根据主族元素最高正化合价与族序数的关系,推出卤族元素最
2010年上海世博会场馆 大量的照明材料或屏幕都使用了发光二极管(LED)。目前市售LED品片 材质
2010年上海世博会场馆,大量的照明材料或屏幕都使用了发光二极管(LED)。目前市售LED品片,材质基本以GaAs(砷化镓)、AlGaInP(磷化铝镓铟)、lnGaN(
A D E X Y五种短周期元素 它们的原子序数依次增大 A元素的原子是半径最小的原子 D元素的最高
A、D、E、X、Y五种短周期元素,它们的原子序数依次增大,A元素的原子是半径最小的原子,D元素的最高价氧化物对应的水化物与其氢化物反应生成一种盐;X与A
A B是短周期VIIA族的两种元素 A的非金属性比B强。下列关于A B的说法正确的是A.A元素的单质
A、B是短周期VIIA族的两种元素,A的非金属性比B强。下列关于A、B的说法正确的是A.A元素的单质可以把B元素的单质从NaB溶液中置换出来B.NaA、NaB的晶体都












