A B是短周期VIIA族的两种元素 A的非金属性比B强。下列关于A B的说法正确的是A.A元素的单质
| A、B是短周期VIIA族的两种元素,A的非金属性比B强。下列关于A、B的说法正确的是 A.A元素的单质可以把B元素的单质从NaB溶液中置换出来 B.NaA、NaB的晶体都是离子晶体,且NaA晶体的熔点比NaB高 C.HA的沸点比HB高,是因为1mol HA分子中H-A键断裂时吸附的能量比1mol HB分子中H-B键断裂时吸收的能量多 D.常温下, 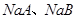 溶液的pH均大于7 溶液的pH均大于7 |
参考解答
| B |
试题分析:A、A、B是短周期VIIA族的两种元素,A的非金属性比B强,则A为F元素,B为Cl元素,F2与NaCl溶液反应,实际反应为F2与H2O反应生成O2,错误;B、短周期VIIA族为活泼非金属,与Na元素结合的化合物为离子化合物,F ̄半径小于Cl ̄半径,则NaF的晶格能大于NaCl的晶格能,所以NaF晶体的熔点比NaCl高,正确;C、HF的沸点比HCl的沸点高,是因为HF分子间形成了氢键,作用力大于HCl分子间的范德华力,错误;D、因为NaCl为强酸强碱盐,所以常温下,NaCl溶液的pH等于7,错误。 |
相似问题
A B C D E F为前四周期元素且原子序数依次增大 其中A含有3个能级 且每个能级所含的电子数相
A、B、C、D、E、F为前四周期元素且原子序数依次增大,其中A含有3个能级,且每个能级所含的电子数相同;C的最外层有6个运动状态不同的电子;D是短周期元素中电
I.下列说法中正确的是 。A.第一电离能由大到小的顺序为O>N>CB.由于C和O互为
I.下列说法中正确的是。A.第一电离能由大到小的顺序为O>N>CB.由于C和O互为等电子体,所以可以推断O的电子式为C.根据岩浆晶出规则,Ca0比Mg0更容易在
漂白精的有效成分是NaClO 其所含氯元素的化合价为[ ]A.2 B.+1 C.-1 D.
漂白精的有效成分是NaClO,其所含氯元素的化合价为[ ]A.2 B.+1 C.-1 D.+2
(1)已知X Y Z为第三周期元素 其原子的第一至第四电离能如下表:电离能/kJ·mol-1I1I2
(1)已知X、Y、Z为第三周期元素,其原子的第一至第四电离能如下表:电离能 kJ·mol-1I1I2I3I4X5781 8172 74511 578Y7381 4517 733
原子序数依次增大的A B C D E F G七种短周期主族元素 ① B元素的原子最外层电子数是次外层
原子序数依次增大的A、B、C、D、E、F、G七种短周期主族元素 ① B元素的原子最外层电子数是次外层电子数的两倍, ② C的最高价氧化物的水化物和氢化物












