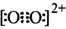I.下列说法中正确的是 。A.第一电离能由大到小的顺序为O>N>CB.由于C和O互为
I.下列说法中正确的是 。
 键。 键。 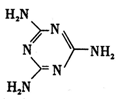 (2)某元素位于第四周期VIII族,其基态原子的未成对电子数与基态碳原子的未成对电子数相同,则其基态原子的M层电子排布式为____ 。 (3)过渡金属配合物Ni( CO)n的中心原子价电子数与配体提供电子总数之和为18,则n=____ 。 (4)碳化硅的晶胞结构(如右图)与金刚石类似(其中“●”为碳原子,“○”为硅原子)。图中“●”点构成的堆积方式与下列图式中 所表示的堆积方式相同。 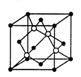 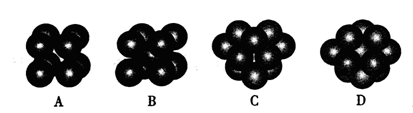 (5)碳化硅的结构中,与碳原子距离最近且相等的碳原子有 个。设晶胞边长为a cm,碳原子直径为b cm,硅原子直径为c cm,则该晶胞的空间利用率为 (用含a、b、c的式子表示)。 |
参考解答
Ⅰ BD(3分) Ⅱ (1)sp2、sp3(2分) 15(1分) (2)3s23p63d8(2分) (3)4(2分) (4)D(2分) (5)12(1分) [2π(b3+c3)/3a3×100%(2分) |
| I.A.不正确,第一电离能由大到小的顺序为N>O>C,N的2P能级是半充满结构,比较稳定; B.正确,由于C 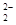 和O 和O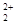 互为等电子体,结构相似; 互为等电子体,结构相似;C.不正确,根据岩浆晶出规则:晶体从岩浆析晶难易程度不仅与岩浆的组成有关而且也与析出晶体的晶格能大小有关:晶格能高的晶体熔点较高更容易在岩浆冷却过程中先结晶,Mg0比Ca0更容易在岩浆冷却过程中先结晶。 D.正确,液态HF通常也可以写成(HF)n的形式,F原子电负性大,液态HF分子间存在氢键。 答案:B D Ⅱ⑴六元环上的N是sp2杂化,氨基上的N是sp3杂化;l mol三聚氰胺分子中含 (6+3×3)mol=15mol  键,答案:sp2杂化、sp3杂化,15mol。 键,答案:sp2杂化、sp3杂化,15mol。⑵第四周期VIII族有Fe、CO、Ni三种原子,基态碳原子的未成对电子数是2,三种原子中基态未成对电子数是2的是Ni,基态原子的M层电子排布式为3S23P63d8,答案:3S23P63d8 ⑶Ni:3d8 4s2为10e,CO:2e,10e + 2e×n = 18,n = 4,CO中只有C提供孤对电子,而C只有一对孤电子对;答案:4; ⑷碳原子构成的堆积方式与D相同,答案:D。 ⑸碳化硅的结构中,与碳原子距离最近且相等的碳原子有12个;该晶胞中C为8×1/8+6×1/2=4,Si原子是4个,球体积公式为V=4/3πR3,原子体积= 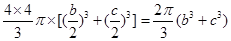 ,空间的利用率为 ,空间的利用率为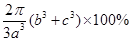 ,答案:12, ,答案:12,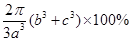 。 。考点:物质的结构,核外电子排布,分子结构、晶体结构、空间利用率计算 |
相似问题
漂白精的有效成分是NaClO 其所含氯元素的化合价为[ ]A.2 B.+1 C.-1 D.
漂白精的有效成分是NaClO,其所含氯元素的化合价为[ ]A.2 B.+1 C.-1 D.+2
(1)已知X Y Z为第三周期元素 其原子的第一至第四电离能如下表:电离能/kJ·mol-1I1I2
(1)已知X、Y、Z为第三周期元素,其原子的第一至第四电离能如下表:电离能 kJ·mol-1I1I2I3I4X5781 8172 74511 578Y7381 4517 733
原子序数依次增大的A B C D E F G七种短周期主族元素 ① B元素的原子最外层电子数是次外层
原子序数依次增大的A、B、C、D、E、F、G七种短周期主族元素 ① B元素的原子最外层电子数是次外层电子数的两倍, ② C的最高价氧化物的水化物和氢化物
A B C均为短周期元素 可形成A2C和BC2两种化合物。A B C的原子序数依次递增 A原子的K层
A、B、C均为短周期元素,可形成A2C和BC2两种化合物。A、B、C的原子序数依次递增,A原子的K层的电子数目只有一个,B位于A的下一周期,它的最外层电子数比K
现有部分短周期元素的性质或原子结构如下表用化学符号回答以下问题:(1)比较:氢化物的稳定性:T___
现有部分短周期元素的性质或原子结构如下表用化学符号回答以下问题:(1)比较:氢化物的稳定性:T_________Z,最高价氧化物对应水化物的酸性:T________