(6分)KNO3和KCl在不同温度时的溶解度如下表所示。温度/℃010203040506070溶解度
(6分)KNO3和KCl在不同温度时的溶解度如下表所示。
(1)20℃时,KNO3的溶解度是 。 (2)30℃时,将KNO3和KCl固体各40g分别加入两只盛有100g水的烧杯中,能得到饱和溶液的是 。将上述得到的不饱和溶液转化为该温度下的饱和溶液,可采用的一种方法是 。 (3)依据上表中数据,已绘制出KNO3和KCl的溶解度曲线(如右图所示),图中能表示KNO3溶解度曲线的是 (填“m”或“n”)。 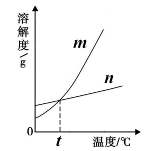 (4)从含有少量KCl的KNO3饱和溶液中得到较多的KNO3晶体,通常可采用的方法是 。 (5)由表中数据分析可知,KNO3和KCl在某一温度t时具有相同的溶解度,则t的取值范围是 。 | |||||||||||||||||||||||||||||
参考解答
| (1)31.6g (2)KCl 加溶质KNO3或恒温蒸发溶剂水 (3)m (4)冷却热饱和溶液(或降温结晶) (5)20~30℃ |
试题分析:(1)根据表中的信息可确定,20℃时KNO3的溶解度为31.6g; (2)根据表格可知,30℃时,KNO3和KCl的溶解度分别是45.8g和37.0g,故在此温度下,将KNO3和KCl固体各40g分别加入两只盛有100g水的烧杯中时,KCl不能完全溶解(有40g-37g=3g剩余),故得到的是饱和溶液。将KNO3的不饱和溶液转化为该温度下的饱和溶液,由于温度不变,故可采用加溶质KNO3或恒温蒸发溶剂水的方法来实现。 (3)根据表中的信息可确定硝酸钾的溶解度随温度变化明显,而氯化钾的溶解度随温度变化很不明显,故表示KNO3溶解度曲线的是m。 (4)由于硝酸钾的溶解度受温度影响较大,而氯化钾的溶解度受温度影响较小,所以要得到较多的KNO3晶体,可先加热溶解,形成硝酸钾的热饱和溶液,然后再降低温度,硝酸钾晶体会很快析出。 (5)判断硝酸钾和氯化钾溶解度相同的温度,即是判断该段中溶解度的数值是否存在相等的可能,经分析可知,在20~30℃时这两种物质存在溶解度相同的可能。 点评:此题是对固体溶解度知识的考查,解题时要学会借助表格的信息,结合溶解度曲线对题目的要求进行分析探讨,此外还要熟记常见物质的溶解度受温度的影响的关系。 |
相似问题
右图是甲 乙两种物质的溶解度曲线。(1)t2℃时 溶解15g甲物质 至少需要 g水。
右图是甲、乙两种物质的溶解度曲线。(1)t2℃时,溶解15g甲物质,至少需要g水。(2)t2℃时,在烧杯中分别盛有等质量的甲、乙两种溶质的饱和溶液,从t2
如右图所示 在盛冷水烧杯中放入甲 乙两支试管(试管中都有未溶解的该溶液的溶质) 若使甲试管中晶体减
如右图所示,在盛冷水烧杯中放入甲 、乙两支试管(试管中都有未溶解的该溶液的溶质),若使甲试管中晶体减少,乙试管中晶体增加,需向烧杯中加入的物质
下图是A B的溶解度曲线。t2℃时分别将100gA B的饱和溶液降温至t1℃ 析出固体治理A
下图是A、B的溶解度曲线。t2℃时分别将100gA、B的饱和溶液降温至t1℃,析出固体治理AB(填“>”、“<”或“=”);把t2℃时150gA的饱和溶液稀释为20%,需加水g。
30oC时 向两支试管中加入等质量的甲和乙 分别加入10g水 使其充分溶解 观察到如下图1所示的实验
30oC时,向两支试管中加入等质量的甲和乙,分别加入10g水,使其充分溶解,观察到如下图1所示的实验现象。下列说法中,正确的是A.图2中的a表示甲的溶解度
(5分) 20℃时 将等质量的甲 乙两种固体物质 分别加入到盛有100g水的烧杯中 充分搅拌后现象如
(5分) 20℃时,将等质量的甲、乙两种固体物质,分别加入到盛有100g水的烧杯中,充分搅拌后现象如图1,加热到50℃时现象如图2,甲、乙两种物质的溶解度曲












