纳米技术制成的金属固体燃料 氢气等已应用到社会生活和高科技领域。单位质量的A和B单质燃烧时均放出大量
纳米技术制成的金属固体燃料、氢气等已应用到社会生活和高科技领域。单位质量的A和B单质燃烧时均放出大量热,可用作燃料。已知A和B为短周期元素,其原子的第一至第四电离能如下表所示:
(1)某同学根据上述信息,推断B的核外电子排布如图所示,该同学所画的电子排布图违背了________。 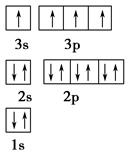 (2)ACl2分子中A的杂化类型为________。 (3)氢气作为一种清洁能源,必须解决它的储存问题,C60可用作储氢材料。已知金刚石中的C—C的键长为154.45 pm,C60中C—C键长为145~140 pm,有同学据此认为C60的熔点高于金刚石,你认为是否正确________,并阐述理由___________________。 (4)科学家把C60和钾掺杂在一起制造了一种富勒烯化合物,其晶胞如图所示,该物质在低温时是一种超导体。写出基态钾原子的价电子排布式______________,该物质的K原子和C60分子的个数比为________。 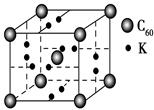 (5)继C60后,科学家又合成了Si60、N60,C、Si、N原子电负性由大到小的顺序是______________________________,NCl3分子的VSEPR模型为________。Si60分子中每个硅原子只跟相邻的3个硅原子形成共价键,且每个硅原子最外层都满足8电子稳定结构,则一个Si60分子中π键的数目为________。 |
参考解答
| (1)能量最低原理 (2)sp杂化 (3)否 C60为分子晶体,熔化时破坏的是分子间作用力,无需破坏共价键 (4)4s1 3︰1 (5)N>C>Si 正四面体 30 |
(1)E(3s)<E(3p),3s轨道排满才能排3p;(2)由表格电离能可推测出A是Be,B是Mg,BeCl2中心原子的价层电子对数为2,采取sp杂化;(3)C60是分子晶体,金刚石是原子晶体,决定二者熔沸点的作用力不同;(4)K原子序数为19,价电子为4s1,从晶胞可看出C60的个数8×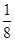 +1=2,K原子的个数12× +1=2,K原子的个数12×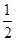 =6,K原子和C60分子的个数比为3︰1;(5)根据同周期、同主族元素原子的电负性递变规律可知:C、Si、N原子电负性由大到小的顺序是N>C>Si;NCl3中心原子价层电子对数为4,VSEPR模型为正四面体;Si的价电子数为4,每个硅原子只跟相邻的3个硅原子相连且最外层都满足8电子稳定结构,所以每个Si原子周围只有1个π键,且2个Si共用1个π键,所以一个Si60分子中π键的数目为(60×1)× =6,K原子和C60分子的个数比为3︰1;(5)根据同周期、同主族元素原子的电负性递变规律可知:C、Si、N原子电负性由大到小的顺序是N>C>Si;NCl3中心原子价层电子对数为4,VSEPR模型为正四面体;Si的价电子数为4,每个硅原子只跟相邻的3个硅原子相连且最外层都满足8电子稳定结构,所以每个Si原子周围只有1个π键,且2个Si共用1个π键,所以一个Si60分子中π键的数目为(60×1)×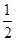 =30。 =30。 |
相似问题
Q R T X Y Z是六种原子序数依次增大的前四周期常见元素 其相关信息如下表:元素相关信息QQ的
Q、R、T、X、Y、Z是六种原子序数依次增大的前四周期常见元素,其相关信息如下表:元素相关信息QQ的单质是实验室常用的惰性电极材料RR原子基态时2p原子轨
有a b c d f五种前四周期元素 原子序数依次增大 a b c三种元素的基态原子具有相同的能层和
有a、b、c、d、f五种前四周期元素,原子序数依次增大,a、b、c三种元素的基态原子具有相同的能层和能级,第一电离能I1(a)<I1(c)<I1(b)且其中基态b原子的2
第4周期元素由于受3d能级电子的影响 性质的递变规律与短周期元素略有不同。Ⅰ.第4周期元素的第一电离
第4周期元素由于受3d能级电子的影响,性质的递变规律与短周期元素略有不同。Ⅰ 第4周期元素的第一电离能随原子序数的增大,总趋势是逐渐增大的。镓(31Ga)的
利用15N可以测定亚硝酸盐对地下水质的污染情况。(1)下列说法正确的是________。A.14N与
利用15N可以测定亚硝酸盐对地下水质的污染情况。(1)下列说法正确的是________。A.14N与15N为同种核素B.14N的第一电离能小于14CC.15NH3与14NH3均能形成
A B C D E为前四周期元素 原子序数依次增大。基态A原子的核外电子占据4个原子轨道;B与C同主
A、B、C、D、E为前四周期元素,原子序数依次增大。基态A原子的核外电子占据4个原子轨道;B与C同主族,大气平流层中单质B3浓度减少会致人患皮肤癌增加;D












