卤族元素的单质和化合物很多 我们可以利用所学物质结构与性质的相关知识去认识和理解(1)卤族元素位于周
| 卤族元素的单质和化合物很多,我们可以利用所学物质结构与性质的相关知识去认识和理解 (1)卤族元素位于周期表的_________区;溴的价电子排布式为______________ (2)在不太稀的溶液中,氢氟酸是以二分子缔合(HF)2形式存在。使氢氟酸分子缔合的作用力是_______ (3)请根据下表提供的第一电离能数据判断:最有可能生成较稳定的单核阳离子的卤素原子是___
(4)已知高碘酸有两种形式,化学式分别为H5IO6(  )和HIO4,前者为五元酸,后者为一元酸。请比较二者酸性强弱:H5IO6_____HIO4 (填“>”、 “<”或“=”) )和HIO4,前者为五元酸,后者为一元酸。请比较二者酸性强弱:H5IO6_____HIO4 (填“>”、 “<”或“=”)(5)已知ClO2-为角型,中心氯原子周围有四对价层电子。ClO2-中心氯原子的杂化轨道类型为___________,写出CN-的等电子体的分子式__________(写出1个) (6)如图为碘晶体晶胞结构。有关说法中正确的是_____________  A.碘分子的排列有2种不同的取向,2种取向不同的碘分子以4配位数交替配位形 成层结构 B.用均摊法可知平均每个晶胞中有4个碘原子 C.碘晶体为无限延伸的空间结构,是原子晶体 D.碘晶体中的碘原子间存在非极性键和范德华力 (7)已知CaF2晶体(见图)的密度为ρg/cm3,NA为阿伏加德罗常数,相邻的两个Ca2+的核间距为a cm,则CaF2的相对分子质量可以表示为___________ 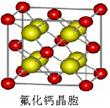 |
参考解答
(1)p;4s24p5(2)氢键(3)碘(4)<(5)sp3杂化,N2 或 CO(6)A、D (7)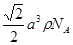 |
试题分析:(1)卤族元素位于周期表的第VIIA,属于p区。35号元素位于第四周期第VIIA,溴的价电子排布式为4s24p5。(2)HF是由分子构成的物质,分子间以分子间作用力结合而成分子晶体。在HF分子之间,除了存在一般的分子间作用力外,由于F原子半径小,电负性大,属于分子间还存在着一种叫氢键的分子间作用力,它使氢氟酸分子缔合在一起,属于通常以聚合分子的形式存在。(3)第一电离能越小,原子越容易失去电子,才最有可能生成较稳定的单核阳离子。由于I的第一电离能最小。属于I原子最可能形成简单的单核阳离子。(4)HIO4是偏高碘酸,H5IO6是正高碘酸,偏高碘酸是强酸,而正高碘酸是弱酸。所以酸性H5IO6<HIO4。(5)ClO2-中心氯原子周围有四对价层电子,所以中心氯原子的杂化轨道类型为sp3杂化。与CN-的等电子体的物质分子式可以是N2 或 CO。(6)由晶胞结构示意图可知:A正确。B。在一个晶胞中含有I2分子个数:8×1/8+6×1/2='4.C.' I2分子构成的是分子晶体。不可能形成原子晶体。错误。D.在碘晶体中的碘分子内的原子间存在非极性键,在分子之间的碘原子之间以范德华力结合。所以碘晶体中的碘原子间存在非极性键和范德华力。正确。(7)在CaF2晶体中,每个晶胞中含有的CaF2的个数为:Ca:8×1/8+6×1/2=4;F:8×1=8.因此每个晶胞中含有4个CaF2。假设晶胞的边长为L.则 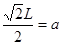 ,所以 ,所以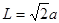 。CaF2晶体的密度为ρg/cm3,所以 。CaF2晶体的密度为ρg/cm3,所以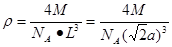 。整理可得: 。整理可得: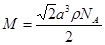 。 。 |
相似问题
金属镍及其化合物在合金材料以及催化剂等方面应用广泛。(1)基态Ni原子的价电子(外围电子)排布式为
金属镍及其化合物在合金材料以及催化剂等方面应用广泛。(1)基态Ni原子的价电子(外围电子)排布式为;(2)金属镍能与CO形成配合物Ni(CO)4,写出与CO互为等电子
在雷达的微波过滤器里使用铁氧磁性体为钇铁石榴石 (Y3Fe5O12) 其中Y最高正价为+3。下列有关
在雷达的微波过滤器里使用铁氧磁性体为钇铁石榴石 (Y3Fe5O12),其中Y最高正价为+3。下列有关叙述中正确的是[ ]A.可表示为3YO3·3FeO·Fe2O3 B.可表
【化学—选修3:物质结构与性质】(15分)氮化钛( Ti3N4)为金黄色晶体 由于具有令人满意的仿金
【化学—选修3:物质结构与性质】(15分)氮化钛( Ti3N4)为金黄色晶体,由于具有令人满意的仿金效果,越来越多地成为黄金代替品。以TiCl4为原料,经过
科学家最近研制出可望成为高效火箭推进剂的N(NO2)3(如图所示)。已知该分子中N—N—N键角都是1
科学家最近研制出可望成为高效火箭推进剂的N(NO2)3(如图所示)。已知该分子中N—N—N键角都是108 1°,下列有关N(NO2)3的说法正确的是A.分子中N、O间形成
(14分)铜单质及其化合物在很多领域有重要的用途 如超细铜粉可应用于导电材料 催化剂等领域中。超细铜
(14分)铜单质及其化合物在很多领域有重要的用途,如超细铜粉可应用于导电材料、催化剂等领域中。超细铜粉的某制备方法如下:(1)[Cu(NH3)4]SO4中,N、O












