【化学—选修3:物质结构与性质】(15分)氮化钛( Ti3N4)为金黄色晶体 由于具有令人满意的仿金
| 【化学—选修3:物质结构与性质】(15分) 氮化钛( Ti3N4)为金黄色晶体,由于具有令人满意的仿金效果,越来越多地成为黄金代替品。以TiCl4为原料,经过一系列反应(如图所示),可以制得Ti3N4和纳米TiO2请回答下列问题:  (1)反应①为置换反应,写出该反应的化学方程式 ;TiCl4分子中4个氯原子不在同一平面上,则TiCl4的空间构型为 。 (2)元素周期表中Ti元素位于第 周期 族。与Ti相邻的元素Zr的基态原子外围电子排布式为 , (3)纳米TiO2是一种应用广泛的催化剂,纳米Ti02催化的一个实验如图所示。 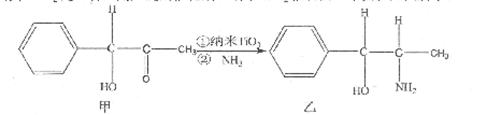 化合物甲的分子中采取sp2方式杂化的碳原子个数为 ,化合物乙中采取sp3杂化的原子的第一电离能由大到小的顺序为 。 (4)有一种氮化钛晶体的晶胞如图所示,该氮化钛晶胞中含有 个N原子,晶胞中N、Ti之间的最近距离为a pm,则该氮化钛的密度为 g.cm-3(NA为阿伏加德常数的数值,只列算式)。  |
参考解答
| (除第(2)题每空1分,其余每空2分,共15分) (1)2Mg+TiCl4 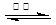 Ti+MgCl2 正四面体 Ti+MgCl2 正四面体(2)四、IVB 4d25S2 (3)7 N>O>C (4)4 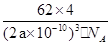 |
试题分析:(1)反应①为置换反应,镁置换钛,所以化学方程式为2Mg+TiCl4 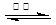 Ti+MgCl2 ;TiCl4的价层电子对数='4+1/2(4-4×1)=4,' TiCl4分子中4个氯原子不在同一平面上,所以TiCl4的空间构型为正四面体型; Ti+MgCl2 ;TiCl4的价层电子对数='4+1/2(4-4×1)=4,' TiCl4分子中4个氯原子不在同一平面上,所以TiCl4的空间构型为正四面体型;(2)元素周期表中Ti元素位于第四周期第IVB族,Zr与Ti同族,在Ti的下一周期,所以外围电子排布式与Ti相似,为4d25s2 (3)采取sp2方式杂化的碳原子周围有3个共价单键,所以甲中的苯环中有6个,-C=O中的1个,共7 个sp2方式杂化的碳原子;根据杂化轨道的判断方法,化合物乙中采取sp3杂化的原子,包括C原子,羟基中的O原子和氨基的N原子,N原子的2p轨道为半充满状态,所以第一电离能最大,C原子的第一电离能最小,所以三者的第一电离能由大到小的顺序为N>O>C; (4)N原子位于立方体的8个顶点和6个面的面心位置,所以晶胞中N原子的个数=8×1/8+6×1/2=4个;Ti原子位于12条棱的中点和立方体的中心,所以晶胞中Ti原子的个数=12×1/4+1=4个;晶胞中N、Ti之间的最近距离为a pm,则晶胞的棱长为2apm=2a×10-10cm,则该氮化钛的密度为4×62/NA/(2a×10-10)3= 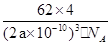 g.cm-3 g.cm-3 |
相似问题
科学家最近研制出可望成为高效火箭推进剂的N(NO2)3(如图所示)。已知该分子中N—N—N键角都是1
科学家最近研制出可望成为高效火箭推进剂的N(NO2)3(如图所示)。已知该分子中N—N—N键角都是108 1°,下列有关N(NO2)3的说法正确的是A.分子中N、O间形成
(14分)铜单质及其化合物在很多领域有重要的用途 如超细铜粉可应用于导电材料 催化剂等领域中。超细铜
(14分)铜单质及其化合物在很多领域有重要的用途,如超细铜粉可应用于导电材料、催化剂等领域中。超细铜粉的某制备方法如下:(1)[Cu(NH3)4]SO4中,N、O
有X Y Z W四种短周期元素 原子序数依次增大 其核电荷数总和为38。Y元素原子最外层电子数占核外
有X、Y、Z、W四种短周期元素,原子序数依次增大,其核电荷数总和为38。Y元素原子最外层电子数占核外总电子数的3 4;W元素原子最外层电子比同周期Z元素多5
近期《美国化学会志》报道 中国科学家以二氧化碳为碳源 金属钠为还原剂 在470℃ 80 MPa下合成
近期《美国化学会志》报道,中国科学家以二氧化碳为碳源,金属钠为还原剂,在470℃、80 MPa下合成出金刚石,具有深远意义。下列说法不正确的是 A.由二
许多金属及它们的化合物在科学研究和工业生产中具有许多用途。回答下列有关问题:(1)基态Ni的核外电子
许多金属及它们的化合物在科学研究和工业生产中具有许多用途。回答下列有关问题:(1)基态Ni的核外电子排布式为______________________________________












