许多金属及它们的化合物在科学研究和工业生产中具有许多用途。回答下列有关问题:(1)基态Ni的核外电子
| 许多金属及它们的化合物在科学研究和工业生产中具有许多用途。 回答下列有关问题: (1)基态Ni的核外电子排布式为__________________________________________, 第二周期基态原子未成对电子数与Ni相同且电负性最小的元素是________。 (2)配合物Ni(CO)n的中心原子价电子数与配体提供电子总数之和为18,则n=________,CO与N2结构相似,CO分子内σ键与π键个数之比为________。 (3)NiO、FeO的晶体结构类型均与氯化钠的相同。 ①Ni2+和Fe2+的离子半径分别为69 pm和78 pm,则熔点NiO________FeO(填“<”或“>”); ②NiO晶体中Ni的配位数为________。 (4)金属Cu单独与氨水或单独与过氧化氢都不能反应,但可与氨水和过氧化氢的混合溶液反应,其原因是________________________________________________________________________________________________________________________________________________, 反应的离子方程式为________________________________________________________________________。 (5)一种铜金合金晶体具有面心立方最密堆积的结构。在晶胞中,Au原子位于顶点,Cu原子位于面心,则该合金中Au原子与Cu原子个数之比为________,若该晶胞的边长为a pm,则合金的密度为________g·cm-3(只要求列算式,不必计算出数值,阿伏加德罗常数为NA)。 |
参考解答
| (1)1s22s22p63s23p63d84s2 C(碳) (2)4 1∶2 (3)①> ②6 (4)H2O2为氧化剂,氨与Cu2+形成配离子,两者相互促进使反应进行 Cu+H2O2+4NH3=Cu(NH3)42++2OH- (5)1∶3 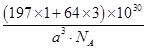 |
(1)Ni基态原子中未成对电子数为2,与之未成对电子数相同的第二周期元素为碳元素和氧元素,电负性最小的为碳元素。(2)Ni原子价电子数为10,配体CO可以提供一个孤电子对,则n=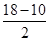 =4;氮氮三键中含有1个σ 键和2个π键,CO与N2结构相似,故CO分子内σ键与π键个数之比为1∶2。(3)①离子晶体中,在其他因素一样时,离子半径越小,离子键就越强,熔点越高;②NiO的晶体结构类型与氯化钠的相同,均为立方最密堆积,Ni原子与O原子的配位数均为6。(4)H2O2具有强氧化性,可以将Cu氧化为Cu2+,但反应速率很小,而氨与Cu2+形成配离子,两个反应相互促进使反应速率加快,反应得以进行。(5)Au原子位于顶点,则一个晶胞中含有Au原子数为8× =4;氮氮三键中含有1个σ 键和2个π键,CO与N2结构相似,故CO分子内σ键与π键个数之比为1∶2。(3)①离子晶体中,在其他因素一样时,离子半径越小,离子键就越强,熔点越高;②NiO的晶体结构类型与氯化钠的相同,均为立方最密堆积,Ni原子与O原子的配位数均为6。(4)H2O2具有强氧化性,可以将Cu氧化为Cu2+,但反应速率很小,而氨与Cu2+形成配离子,两个反应相互促进使反应速率加快,反应得以进行。(5)Au原子位于顶点,则一个晶胞中含有Au原子数为8×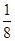 =1,Cu原子位于面心,则一个晶胞中含有Cu原子数为6× =1,Cu原子位于面心,则一个晶胞中含有Cu原子数为6× =3,故该合金中Au原子与Cu原子个数之比为1∶3;一个晶胞的质量为 =3,故该合金中Au原子与Cu原子个数之比为1∶3;一个晶胞的质量为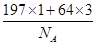 g,一个晶胞的体积为a3 pm3,故合金的密度为 g,一个晶胞的体积为a3 pm3,故合金的密度为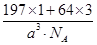 g·pm-3= g·pm-3=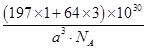 g·cm-3。 g·cm-3。 |
相似问题
某配位化合物为深蓝色晶体 由原子序数依次增大的A B C D E五种元素组成 其原子个数比为l4:4
某配位化合物为深蓝色晶体,由原子序数依次增大的A、B、C、D、E五种元素组成,其原子个数比为l4:4:5:1:1。其中C、D元素同主族且原子序数D为C的二倍,E元
X Y Z M R W为六种短周期元素 原子序数依次递增。Y Z M是同周期元素 且Z M最外层电子
X、Y、Z、M、R、W为六种短周期元素,原子序数依次递增。Y、Z、M是同周期元素,且Z、M最外层电子数之差为1。X+ 无电子,—ZX是有机物中常见官能团。Y是组
黑火药是中国四大发明之一 其爆炸的化学反应方程式是:2KNO3 + 3C + S→+ N2↑ + 3
黑火药是中国四大发明之一,其爆炸的化学反应方程式是:2KNO3 + 3C + S→+ N2↑ + 3CO2↑(1)方程式中第二周期元素中非金属性由强到弱的顺序依次
M是原子序数
M是原子序数<30的一种金属,常用于航空、宇航、电器及仪表等工业部门,M原子的最外层有空轨道,且有两个能级处于电子半充满状态。(1)M原子的外围电子排
在电解炼铝过程中加入冰晶石(用“A”代替) 可起到降低Al2O3熔点的作用。冰晶石的生产原理为2Al
在电解炼铝过程中加入冰晶石(用“A”代替),可起到降低Al2O3熔点的作用。冰晶石的生产原理为2Al(OH)3+12HF+3Na2CO3=2A+3CO2↑+9H2O。根据题意完












