在电解炼铝过程中加入冰晶石(用“A”代替) 可起到降低Al2O3熔点的作用。冰晶石的生产原理为2Al
| 在电解炼铝过程中加入冰晶石(用“A”代替),可起到降低Al2O3熔点的作用。冰晶石的生产原理为2Al(OH)3+12HF+3Na2CO3=2A+3CO2↑+9H2O。根据题意完成下列填空: (1)冰晶石的化学式为________,含有离子键、________等化学键。 (2)生成物中含有10个电子的分子是________(写分子式),该分子的空间构型为________,中心原子的杂化方式为________。 (3)反应物中电负性最大的元素为________(填元素符号),写出其原子最外层的电子排布图:________。 (4)Al单质的晶体中原子的堆积方式如图甲所示,其晶胞特征如图乙所示,原子之间相互位置关系的平面图如图丙所示。 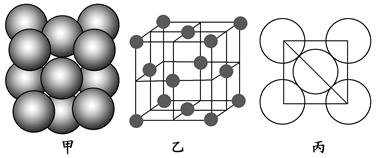 若已知Al的原子半径为d,NA代表阿伏加德罗常数,Al的相对原子质量为M,则一个晶胞中Al原子的数目为________;Al晶体的密度为________(用字母表示)。 |
参考解答
| (1)Na3AlF6 配位键 (2)H2O V形 sp3 (3)F 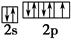 (4)4  |
(1)冰晶石的化学式为Na3AlF6,Na+与AlF63-之间为离子键,而AlF63-是以配位键形成的。(2)生成物中10电子分子是H2O,氧原子采取sp3杂化,由于氧原子含有两对孤电子对,故分子结构为V形。(3)F是电负性最大的元素,其最外层电子排布图为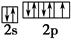 。(4)铝晶胞的原子处于晶胞顶角和面心,故一个晶胞含有的Al原子数目为6× 。(4)铝晶胞的原子处于晶胞顶角和面心,故一个晶胞含有的Al原子数目为6× +8× +8×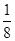 =4。设Al晶胞的边长为a,则有:2a2=(4d)2,a=2 =4。设Al晶胞的边长为a,则有:2a2=(4d)2,a=2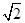 d,Al晶胞的体积为V=16 d,Al晶胞的体积为V=16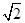 d3,故Al晶体的密度为 d3,故Al晶体的密度为 。 。 |
相似问题
A B C D E F为原子序数依次增大的短周期主族元素。已知A C F3种原子的最外层共有11个电
A、B、C、D、E、F为原子序数依次增大的短周期主族元素。已知A、C、F3种原子的最外层共有11个电子,且这3种元素的最高价氧化物的水化物之间两两皆能反应,
现有A B C D E五种元素 它们的质子数依次增多。 ①A的核电荷数大于2 可形成氢化物H2A 该
现有A、B、C、D、E五种元素,它们的质子数依次增多。 ①A的核电荷数大于2,可形成氢化物H2A,该氢化物在常温下是液体; ②A和B两元素可形成B2A3化合物
按照HCl ( ) Ca(ClO)2 Cl2O5 HClO4的排列规律 选出一种符合括号内的物质[
按照HCl、( )、Ca(ClO)2、Cl2O5、HClO4的排列规律,选出一种符合括号内的物质[ ]A.NaCl B.NaClO C.Cl2O7 D.Cl2
X Y Z L M五种元素的原子序数依次增大。X Y Z L是组成蛋白质的基础元素 M是地壳中含量最
X、Y、Z、L、M五种元素的原子序数依次增大。X、Y、Z、L是组成蛋白质的基础元素,M是地壳中含量最高的金属元素。回答下列问题:(1)L的元素符号为_______
【物质结构与性质】天冬酰胺(结构如右图)在芦笋中含量丰富 具有提高身体免疫力的功效。(1)天冬酰胺所
【物质结构与性质】天冬酰胺(结构如右图)在芦笋中含量丰富,具有提高身体免疫力的功效。(1)天冬酰胺所含元素中(填元素名称)元素基态原子核外未成对












