(14分)铜单质及其化合物在很多领域有重要的用途 如超细铜粉可应用于导电材料 催化剂等领域中。超细铜
(14分)铜单质及其化合物在很多领域有重要的用途,如超细铜粉可应用于导电材料、催化剂等领域中。超细铜粉的某制备方法如下: (1)[Cu(NH3)4]SO4中,N、O、S三种元素的第一电离能从大到小的顺序为: 。 (2) SO42-中硫原子的杂化轨道类型是 :写出一种与SO42-互为等电子体的分子 。 (3)某反应在超细铜粉做催化剂作用下生成 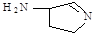 ,则分子中 σ 键与 π 键之比为 ,则分子中 σ 键与 π 键之比为 (4)该化合物[Cu(NH3)4]SO4中存在的化学键类型有 。(填字母)
(6)铜的某氯化物的晶胞结构如图所示,该化合物的化学式为 。 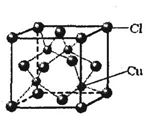 |
参考解答
(1)N>O>S (2)SP3杂化,CCl4 (3)14∶1 (4)ACE(选对两个得1分,只要选错得0分) (5)1S22S22P63S23P63d10或[Ar 3d10 (6)CuCl |
试题分析:(1)氮原子最外层p能级是半充满,稳定,第一电离能能比氧的大,同主族从上到下第一电离能逐渐减小,故为N>O>S;(2) SO42-离子中价层电子对数为4+1/2(6+2―4×2)=4,孤电子对数为0,SP3杂化,所以是正四面体构型.原子个数相等且价电子数相等的微粒为等电子体,与SO42-互为等电子体的分子如:CCl4 ;(3)共价单键是σ键,共价双键中一个是σ键一个是π键,该物质中含有14个σ键1个是π键,所以分子中σ键与π键之比为14:1;(4)[Cu (NH3 )4SO4中硫酸根离子和[Cu(NH3)42+存在离子键,N原子和铜原子之间存在配位键,NH3中H和N之间存在共价键,所以[Cu(NH3)4SO4中所含的化学键有共价键、离子键、配位键,故选ACE;(5)NH4CuSO3中的金属阳离子是Cu+,基态Cu+核外有28个电子,根据构造原理知其核外电子排布式为:1S22S22P63S23P63d10或[Ar3d10;(6)该晶胞中铜原子个数是4,氯原子个数=8×1/8+6×1/2=4,所以其化学式为:CuCl; |
相似问题
有X Y Z W四种短周期元素 原子序数依次增大 其核电荷数总和为38。Y元素原子最外层电子数占核外
有X、Y、Z、W四种短周期元素,原子序数依次增大,其核电荷数总和为38。Y元素原子最外层电子数占核外总电子数的3 4;W元素原子最外层电子比同周期Z元素多5
近期《美国化学会志》报道 中国科学家以二氧化碳为碳源 金属钠为还原剂 在470℃ 80 MPa下合成
近期《美国化学会志》报道,中国科学家以二氧化碳为碳源,金属钠为还原剂,在470℃、80 MPa下合成出金刚石,具有深远意义。下列说法不正确的是 A.由二
许多金属及它们的化合物在科学研究和工业生产中具有许多用途。回答下列有关问题:(1)基态Ni的核外电子
许多金属及它们的化合物在科学研究和工业生产中具有许多用途。回答下列有关问题:(1)基态Ni的核外电子排布式为______________________________________
某配位化合物为深蓝色晶体 由原子序数依次增大的A B C D E五种元素组成 其原子个数比为l4:4
某配位化合物为深蓝色晶体,由原子序数依次增大的A、B、C、D、E五种元素组成,其原子个数比为l4:4:5:1:1。其中C、D元素同主族且原子序数D为C的二倍,E元
X Y Z M R W为六种短周期元素 原子序数依次递增。Y Z M是同周期元素 且Z M最外层电子
X、Y、Z、M、R、W为六种短周期元素,原子序数依次递增。Y、Z、M是同周期元素,且Z、M最外层电子数之差为1。X+ 无电子,—ZX是有机物中常见官能团。Y是组












