硫酸工厂尾气处理时用NaOH溶液吸收SO2生成NaHSO3 再用NaIO3按下列反应(配平)来制取单
| 硫酸工厂尾气处理时用NaOH溶液吸收SO2生成NaHSO3,再用NaIO3按下列反应(配平)来制取单质I2。NaIO3来源于自然界的矿物。 ① NaIO3 + NaHSO3— NaI + Na2SO4 + H2SO4 ② IO3-+I-+H+—I2+H2O (1)配平上述反应 (2)在含5molNaHSO3的溶液中逐滴加入NaIO3溶液。请计算开始产生单质I2及产生单质I2最大值时所滴入的NaIO3的物质的量各是多少? (3)25℃时,H2SO3  HSO3- + H+的电离常数Ka= 1×10-2 mol/L,则该温度下NaHSO3的水解平衡常数Kh= mol/L,若向NaHSO3溶液中加入少量的I2,则溶液中 HSO3- + H+的电离常数Ka= 1×10-2 mol/L,则该温度下NaHSO3的水解平衡常数Kh= mol/L,若向NaHSO3溶液中加入少量的I2,则溶液中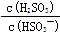 将 (填“增大”“减小”或“不变”,下同); 加入少量NaOH溶液, 将 (填“增大”“减小”或“不变”,下同); 加入少量NaOH溶液,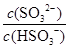 的值 ;加入少量水,水的电离程度将 。 的值 ;加入少量水,水的电离程度将 。 |
参考解答
| (1)2NaIO3 + 6NaHSO3 =2NaI + 3Na2SO4 + 3H2SO4 IO3-+5I-+6H+= 3I2+3H2O (2)5/3mol 2mol (3)1.0×10-12,增大,增大,增大 |
试题分析:(1)这两个反应均为氧化还原反应,要符合电子守恒和原子守恒。对第二个反应来说,是离子反应,还要符合电荷守恒。配平后的方程式为:2NaIO3 + 6NaHSO3 =2NaI + 3Na2SO4 + 3H2SO4 IO3-+5I-+6H+= 3I2+3H2O (2)开始产生I2时,第一个反应恰好完成,第二个反应刚刚开始。有方程式2NaIO3 + 6NaHSO3 =2NaI + 3Na2SO4 + 3H2SO4可知:n(NaIO3):n(NaHSO3)=2:6=1:3,所以n(NaIO3)='1/3' n(NaHSO3) = 1/3×5mol=5/3mol.产生单质I2最大值时第一个反应产生的I-完全发生第二个反应。n(I-)= 1/3n(NaHSO3)= 5/3 mol,发生第二个反应消耗的NaIO3的物质的量为n(NaIO3)=1/5×5/3mol=1/3mol.所以一共消耗的的NaIO3的物质的量为n(NaIO3)= 5/3mol+1/3mol=2mol.(3) H2SO3  HSO3- + H+的电离常数Ka= {C(H+)·C(HSO3-) ÷C(H2SO3)= 1×10-2 mol/L; NaHSO3的水解平衡为HSO3-+H2O HSO3- + H+的电离常数Ka= {C(H+)·C(HSO3-) ÷C(H2SO3)= 1×10-2 mol/L; NaHSO3的水解平衡为HSO3-+H2O H2SO3 + OH-。水解平衡常数Kh=' {' C(OH-)·C(H2SO3)÷{ C(HSO3-)·C(H2O). Ka·Kh= {C(H+)·C(OH-)÷C(H2O). Kh= {C(H+)·C(OH-) ÷{C(H2O)·Ka =1.0×10-14÷1.0×10-2=1.0×10-12. 若向NaHSO3溶液中加入少量的I2,会发生反应:H2SO3+ I2+H2O= H2SO4+ 2HI;使平衡H2SO3 H2SO3 + OH-。水解平衡常数Kh=' {' C(OH-)·C(H2SO3)÷{ C(HSO3-)·C(H2O). Ka·Kh= {C(H+)·C(OH-)÷C(H2O). Kh= {C(H+)·C(OH-) ÷{C(H2O)·Ka =1.0×10-14÷1.0×10-2=1.0×10-12. 若向NaHSO3溶液中加入少量的I2,会发生反应:H2SO3+ I2+H2O= H2SO4+ 2HI;使平衡H2SO3 HSO3- + H+向逆反应方向移动,则溶液中 HSO3- + H+向逆反应方向移动,则溶液中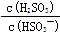 将增大。若加入少量NaOH溶液,由于发生反应:H++OH-= H2O,使平衡HSO3 - 将增大。若加入少量NaOH溶液,由于发生反应:H++OH-= H2O,使平衡HSO3 - SO32- + H+向正反应方向移动, SO32- + H+向正反应方向移动,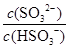 的值增大。若加入少量水,盐的水解程度增大,使水的电离程度也增大。 的值增大。若加入少量水,盐的水解程度增大,使水的电离程度也增大。 |
相似问题
用KMnO4氧化密度为1.2 g·cm-3 溶质质量分数为36.5%的HCl溶液。反应方程式如下:2
用KMnO4氧化密度为1 2 g·cm-3,溶质质量分数为36 5%的HCl溶液。反应方程式如下:2KMnO4+16HCl===2KCl+2MnCl2+5Cl2↑+8H2O,15 8gKMnO4能使ml HCl
对于白磷引起的中毒 硫酸铜溶液是一种解毒剂 有关反应如下:1lP+15CuSO4+24H2O=5Cu
对于白磷引起的中毒,硫酸铜溶液是一种解毒剂,有关反应如下:1lP+15CuSO4+24H2O=5Cu3P+6H3PO4+15H2SO4,下列关于该反应说法错误的是:A.生成1 mo
将0.3mol KMnO4在一定温度下加热后生成x molO2;将剩余固体与过量浓盐酸混合加热又生成
将0 3mol KMnO4在一定温度下加热后生成x molO2;将剩余固体与过量浓盐酸混合加热又生成y mol Cl2,此时锰元素全部以Mn2+形式存在。若x+y=a,则a的值
a mo1 FeS与b mol FeO投入到稀硝酸溶液中充分反应后无固体剩余 得到Fe(NO3)3相
a mo1 FeS与b mol FeO投入到稀硝酸溶液中充分反应后无固体剩余,得到Fe(NO3)3相H2SO4的混合溶液,并产生NO气体。则反应中氧化产物与还原产物的物质
已知氧化还原反应:KClO3+6HCl(浓)===KCl+3Cl2↑+3H2O其中1 mol氧化剂在
已知氧化还原反应:KClO3+6HCl(浓)===KCl+3Cl2↑+3H2O其中1 mol氧化剂在反应中得到的电子为( )A.6 molB.5 molC.3 molD.4 mol












