用KMnO4氧化密度为1.2 g·cm-3 溶质质量分数为36.5%的HCl溶液。反应方程式如下:2
| 用KMnO4氧化密度为1.2 g·cm-3,溶质质量分数为36.5%的HCl溶液。反应方程式如下:2KMnO4+16HCl===2KCl+2MnCl2+5Cl2↑+8H2O,15.8gKMnO4能使 ml HCl溶液发生上述反应。.有_______molHCl被氧化,产生的Cl2在标准状况下的体积为 L |
参考解答
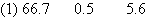 |
| 略 |
相似问题
对于白磷引起的中毒 硫酸铜溶液是一种解毒剂 有关反应如下:1lP+15CuSO4+24H2O=5Cu
对于白磷引起的中毒,硫酸铜溶液是一种解毒剂,有关反应如下:1lP+15CuSO4+24H2O=5Cu3P+6H3PO4+15H2SO4,下列关于该反应说法错误的是:A.生成1 mo
将0.3mol KMnO4在一定温度下加热后生成x molO2;将剩余固体与过量浓盐酸混合加热又生成
将0 3mol KMnO4在一定温度下加热后生成x molO2;将剩余固体与过量浓盐酸混合加热又生成y mol Cl2,此时锰元素全部以Mn2+形式存在。若x+y=a,则a的值
a mo1 FeS与b mol FeO投入到稀硝酸溶液中充分反应后无固体剩余 得到Fe(NO3)3相
a mo1 FeS与b mol FeO投入到稀硝酸溶液中充分反应后无固体剩余,得到Fe(NO3)3相H2SO4的混合溶液,并产生NO气体。则反应中氧化产物与还原产物的物质
已知氧化还原反应:KClO3+6HCl(浓)===KCl+3Cl2↑+3H2O其中1 mol氧化剂在
已知氧化还原反应:KClO3+6HCl(浓)===KCl+3Cl2↑+3H2O其中1 mol氧化剂在反应中得到的电子为( )A.6 molB.5 molC.3 molD.4 mol
NH3具有一定的还原性 常温下可被Cl2氧化为N2。在一密闭容器中 充入一定量NH3和Cl2充分反
NH3具有一定的还原性,常温下可被Cl2氧化为N2。在一密闭容器中,充入一定量NH3和Cl2充分反应后,恢复到原状态所得气体产物体积最小,则反应前Cl2和NH3












