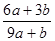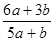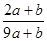a mo1 FeS与b mol FeO投入到稀硝酸溶液中充分反应后无固体剩余 得到Fe(NO3)3相
a mo1 FeS与b mol FeO投入到稀硝酸溶液中充分反应后无固体剩余,得到Fe(NO3)3相H2SO4的混合溶液,并产生NO气体。则反应中氧化产物与还原产物的物质的量之比为
|
参考解答
| A |
试题分析:该反应中元素的化合价变化为:S元素化合价由-2价变为+6价,失去8个电子。Fe元素化合价由+2价变为+3价,失去1个电子。N元素化合价由+5价变为+2价,得到3个电子。所以反应中氧化产物是Fe(NO3)3和H2SO4,还原产物是NO。设生成NO的物质的量为x,根据电子得失守恒可知,a×[6-(-2)+(3-2)mol+b×(3-2)mol=(5-2)×x,解得x= 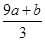 mol。根据原子守恒知,氧化产物的物质的量=(a+b)mol+amol=(2a+b)mol,所以氧化产物和还原产物的物质的量之比= mol。根据原子守恒知,氧化产物的物质的量=(a+b)mol+amol=(2a+b)mol,所以氧化产物和还原产物的物质的量之比=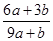 ,答案选A。 ,答案选A。 |
相似问题
已知氧化还原反应:KClO3+6HCl(浓)===KCl+3Cl2↑+3H2O其中1 mol氧化剂在
已知氧化还原反应:KClO3+6HCl(浓)===KCl+3Cl2↑+3H2O其中1 mol氧化剂在反应中得到的电子为( )A.6 molB.5 molC.3 molD.4 mol
NH3具有一定的还原性 常温下可被Cl2氧化为N2。在一密闭容器中 充入一定量NH3和Cl2充分反
NH3具有一定的还原性,常温下可被Cl2氧化为N2。在一密闭容器中,充入一定量NH3和Cl2充分反应后,恢复到原状态所得气体产物体积最小,则反应前Cl2和NH3
二氧化氯(ClO2)为一种黄绿色气体 是国际上公认的高效 广谱 快速 安全的杀菌消毒剂。(1)工业上
二氧化氯(ClO2)为一种黄绿色气体,是国际上公认的高效、广谱、快速、安全的杀菌消毒剂。(1)工业上制备ClO2的反应原理常采用:2NaClO3+4HCl=2ClO2↑
已知溶液中:还原性HSO3->I- 氧化性IO3-> I2 > SO42-。在含3 molNaHSO
已知溶液中:还原性HSO3->I-,氧化性IO3-> I2 > SO42-。在含3 molNaHSO3的溶液中逐滴加入KIO3溶液,加入的KIO3和析出的I2的物质的量的关系曲线如
Ⅰ.某溶液中仅含下表离予中的5种离子(不考虑水的电离及离子的水解) 且各离子的物质的量均相等都为0.
Ⅰ.某溶液中仅含下表离予中的5种离子(不考虑水的电离及离子的水解),且各离子的物质的量均相等都为0.0lmol。①若向原溶液中加入KSCN溶液,无明显变化