在某100 mL的混合液中 硝酸和硫酸的物质的量浓度分别是0.4 mol/L 0.1 mol/L 向
| 在某100 mL的混合液中,硝酸和硫酸的物质的量浓度分别是0.4 mol/L、 0.1 mol/L,向该混合液中加入1.92 g铜粉,加热,待充分反应后,所得溶液中铜离子物质的量浓度是( )
|
参考解答
| B |
溶液中同时存在H+和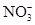 时就能够与Cu发生反应。该溶液中 H+实际为 0.06 mol,应该根据离子方程式进行计算,正确解题思路为: 时就能够与Cu发生反应。该溶液中 H+实际为 0.06 mol,应该根据离子方程式进行计算,正确解题思路为:3Cu + 8H+ + 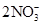 =3Cu2+ +2NO↑ +4H2O =3Cu2+ +2NO↑ +4H2O3 8 2 3 0.03 mol 0.06 mol 0.04 mol x 根据各物质量的关系可知, H+不足,应根据H+进行计算。x=3×0.06 mol÷8= 0.022 5 mol, 因此,铜离子浓度为0.225 mol /L。 |
相似问题
现取m g镁铝合金在一定浓度的稀硝酸中恰好完全溶解(硝酸的还原产物只有NO) 向反应后的混合溶液中滴
现取m g镁铝合金在一定浓度的稀硝酸中恰好完全溶解(硝酸的还原产物只有NO),向反应后的混合溶液中滴加b mol L NaOH溶液,当滴加到V mL时,得到沉淀质
向27.2 g Cu和Cu2O的混合物中加入某浓度的稀硝酸0.5 L 固体物质完全反应 生成NO和C
向27 2 g Cu和Cu2O的混合物中加入某浓度的稀硝酸0 5 L,固体物质完全反应,生成NO和Cu(NO3)2。在所得溶液中加入1 0 molL-1的NaOH溶液1 0 L,此时溶
高铁酸钾(K2FeO4)是一种集氧化 吸附 絮凝于一体的新型多功能水处理剂。其生产工艺流程如下:请同
高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂。其生产工艺流程如下:请同答下列问题:(l)写出向KOH溶液中通入足量Cl2发生反应的
氮气及含氮的化合物在国民经济中占有重要地位。合成氨工业中 合成塔中每产生2 mol NH3 放出92
氮气及含氮的化合物在国民经济中占有重要地位。合成氨工业中,合成塔中每产生2 mol NH3,放出92 4 kJ热量。 (1)若起始时向容器内放入2 mol N2和6
若(NH4)2SO4在强热时分解的产物是SO2 N2 NH3和H2O 则该反应中化合价发生变化和未发
若(NH4)2SO4在强热时分解的产物是SO2、N2、NH3和H2O,则该反应中化合价发生变化和未发生变化的N原子数之比为( )A.1:4B.1:2C.2:1D.4:1












