氮气及含氮的化合物在国民经济中占有重要地位。合成氨工业中 合成塔中每产生2 mol NH3 放出92
| 氮气及含氮的化合物在国民经济中占有重要地位。合成氨工业中,合成塔中每产生2 mol NH3,放出92.4 kJ热量。 (1)若起始时向容器内放入2 mol N2和6 mol H2,达平衡后放出的热量为Q,则Q_____184.8kJ(填“>”、“<”或“=”) 。 一定条件下,在密闭恒容的容器中,能表示反应达到化学平衡状态的是____________。 a.3v逆(N2)=v正(H2) b.2v正(H2)= v正(NH3) c.混合气体密度保持不变 d.c(N2):c(H2):c(NH3)=1:3:2 工业生产尿素的原理是以NH3和CO2为原料合成尿素[CO(NH2)2],反应的化学方程式为2NH3 (g)+ CO2 (g)  CO(NH2)2 (l) + H2O (l)。 CO(NH2)2 (l) + H2O (l)。(2)在一定温度和压强下,若原料气中的NH3和CO2的物质的量之比(氨碳比)  ,右图是氨碳比(x)与CO2平衡转化率(α)的关系。α随着x增大而增大的原因是___________。 ,右图是氨碳比(x)与CO2平衡转化率(α)的关系。α随着x增大而增大的原因是___________。(3)图中的B点处,NH3的平衡转化率为_______。 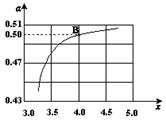 已知:3Cl2+2NH3→N2+6HCl ――① 3Cl2+8NH3→N2+6NH4Cl ――② (4)完成并配平下列氧化还原反应方程式,再标出电子转移的方向和数目: 12Cl2+15NH3→ ――③ (5)反应③中的还原剂是 ,还原产物是 。 (6)若按③反应后产生气体9.408L(标准状况),则被氧化的气体的物质的量是 mol。 |
参考解答
| (1)< a (共2分,各1分) (2)c(NH3)增大,平衡正向移动,所以CO2的转化率增大 (1分) (3)25% (2分)  (4)12Cl2+15NH3→ 4 N2+ 7 NH4Cl + 17 HCl (5)NH3(1分) NH4Cl 和HCl (各0.5分,共1分) (6)0.16 (2分) |
试题分析:(1)由于合成氨的反应是可逆反应,若起始时向容器内放入2 mol N2和6 mol H2,达平衡后不可能有4mol氨气生成,故放出的热量为Q<184.8kJ。 一定条件下,在密闭恒容的容器中,能表示反应达到化学平衡状态的是 a.3v逆(N2)=v正(H2) 相当于同一物质的正逆反应相等,正确; (2)根据方程式,c(NH3)增大,平衡正向移动,所以CO2的转化率增大。 (3)图中的B点处,x=4,原料气中的NH3和CO2的物质的量之比为4,二氧化碳转化率为50%,假设氨气为4mol,二氧化碳为1mol,则反应的二氧化碳为0.5mol,依据化学方程式2NH3(g)+CO2(g)?CO(NH2)2(l)+H2O(l)反应的氨气为1mol,NH3的平衡转化率=1/4×100%=25%;故答案为:25%; (4)运用氧化还原反应原理书写为2Cl2+15NH3=' 4' N2+ 7 NH4Cl + 17 HCl ,转移电子数为24e。 (5)反应③中的还原剂是NH3,还原产物是NH4Cl 和HCl。34.生成气体9.408L(标准状况),可求得其中氮气占了4/21,则被氧化的气体的物质的量就为氮气的8倍,即为0.16mol。 |
相似问题
若(NH4)2SO4在强热时分解的产物是SO2 N2 NH3和H2O 则该反应中化合价发生变化和未发
若(NH4)2SO4在强热时分解的产物是SO2、N2、NH3和H2O,则该反应中化合价发生变化和未发生变化的N原子数之比为( )A.1:4B.1:2C.2:1D.4:1
把一定质量的铁完全溶解于某浓度的硝酸中收集到0.3 mol NO2和0.2 mol NO。向反应后的
把一定质量的铁完全溶解于某浓度的硝酸中收集到0 3 mol NO2和0 2 mol NO。向反应后的溶液中加入足量NaOH溶液充分反应,经过滤、洗涤后,把所得沉淀加
有一铁的氧化物样品 用140 mL 5 mol·L-1盐酸可恰好使其完全溶解。所得溶液可吸收标准状况
有一铁的氧化物样品,用140 mL 5 mol·L-1盐酸可恰好使其完全溶解。所得溶液可吸收标准状况下0.56 L氯气,使其中的Fe2+全部转化为Fe3+。该样品可
下列叙述不正确的是A.Li+中含有的中子数与电子数之比为2︰1B.在C2H6分子中极性共价键与非极性
下列叙述不正确的是A.Li+中含有的中子数与电子数之比为2︰1B.在C2H6分子中极性共价键与非极性共价键数之比为6︰1C.常温下,11 2 L的甲烷气体中含有的
在一定条件下 RO与R-可发生反应:RO+5R-+6H+===3R2+3H2O 下列关于R元素的叙述
在一定条件下,RO与R-可发生反应:RO+5R-+6H+===3R2+3H2O,下列关于R元素的叙述中,正确的是( )A.元素R位于周期表中第ⅤA族B.RO中的R只能被还












