(12分)按图所示实验过程填空:(1)写出上述反应的离子方程式:①
(12分)按图所示实验过程填空: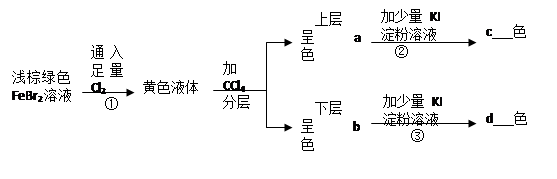 (1)写出上述反应的离子方程式: ① ② ③ (2)填空: a b c d |
参考解答
| (1)① 2Fe2++4Br-+3Cl2=2Fe3++6Cl-+2Br2 (2分) ② 2Fe3++2I-=2Fe2++I2 (3分) ③ Br2+2I-=2Br-+I2 (3分) (2) a 棕黄 b 橙红 c蓝 d 蓝色 (各1分) |
试题分析:①发生的反应为:2Fe2++4Br-+3Cl2=2Fe3++6Cl-+2Br2,所得的黄色液体为溴水。加CCl4后分层,上层为FeCl3溶液,呈棕黄色;下层为溴的CCl4溶液,呈橙红色;②发生的反应为:2Fe3++2I-=2Fe2++I2,反应后所得的溶液的溶质为I2,I2遇淀粉变蓝色。③发生的反应为:Br2+2I-=2Br-+I2,淀粉遇碘变蓝色。 点评:此题考查卤素单质之间的相互转换,属于基础题。对于卤素单质,应特别注意其颜色。 |
相似问题
自然界地表层原生铜的硫化物经氧化 淋滤作用后变成CuSO4溶液 向地下深层渗透 遇到难溶的ZnS或P
自然界地表层原生铜的硫化物经氧化、淋滤作用后变成CuSO4溶液,向地下深层渗透,遇到难溶的ZnS或PbS,慢慢转变为铜蓝(CuS)。下列分析正确的是A.CuS的
(1)将废钒催化剂(主要成分V2O5)与稀硫酸 亚硫酸钾溶液混合 充分反应 所得溶液显酸性 含VO2
(1)将废钒催化剂(主要成分V2O5)与稀硫酸、亚硫酸钾溶液混合,充分反应,所得溶液显酸性,含VO2+、K+、SO42-等。写出该反应的化学方程式_____________
氮化铝(AlN)广泛应用于电子 陶瓷等工业等领域。在一定条件下 AlN可通过如下反应制取: 下列叙述
氮化铝(AlN)广泛应用于电子、陶瓷等工业等领域。在一定条件下,AlN可通过如下反应制取:,下列叙述正确的是 ( )A.AlN中氮的化合价为+3B.AlN的摩尔
金属冶炼和处理常涉及氧化还原反应。(1)由下列物质冶炼相应金属时采用电解法的是 a.
金属冶炼和处理常涉及氧化还原反应。(1)由下列物质冶炼相应金属时采用电解法的是a.Fe2O3b.NaCl c.Cu2S d.Al2O3(2)辉铜矿(Cu2S)可发生反应2Cu
重铬酸钠俗称红矾钠(Na2Cr2O7·2H2O)是重要的化工产品和强氧化剂。工业上通过煅烧铬铁矿制取
重铬酸钠俗称红矾钠(Na2Cr2O7·2H2O)是重要的化工产品和强氧化剂。工业上通过煅烧铬铁矿制取,其反应如下:反应Ⅰ 4Fe(CrO2)2+8Na2CO3+7O2 → 2Fe2O












