金属冶炼和处理常涉及氧化还原反应。(1)由下列物质冶炼相应金属时采用电解法的是 a.
| 金属冶炼和处理常涉及氧化还原反应。 (1)由下列物质冶炼相应金属时采用电解法的是 a.Fe2O3 b.NaCl c.Cu2S d.Al2O3 (2)辉铜矿(Cu2S)可发生反应2Cu2S+2H2SO4+5O2=4CuSO4+ 2H2O,该反应的还原剂是 ,当1mol O2发生反应时,还原剂所失电子的物质的量为 mol。向CuSO4溶液中加入镁条时有气体生成,该气体是 (3)为处理银器表面的黑斑(Ag2S),将银器置于铝制容器里的食盐水中并与铝接触,Ag2S转化为Ag,食盐水的作用为 (4)某化学小组在实验中用浓硝酸和铜反应制取二氧化氮并探究二氧化氮是否能支持木炭的燃烧,其实验装置图如下: 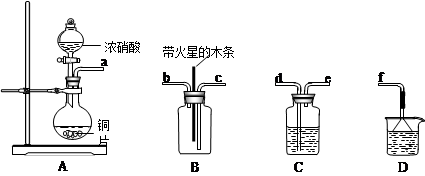 ①按气流方向连接各仪器接口,顺序为a→______→______→______→______→f。 ②已知二氧化氮和碳反应生成两种物质的量比为1:1的有毒气体,则该反应的化学方程式为:___________________________。 |
参考解答
(1)bd (2)Cu2S(1分);4;氢气(1分) (3)做电解质溶液,形成原电池。(4)①d→e→c→b(2分); ②NO2+C  CO+NO(2分) CO+NO(2分) |
试题分析:(1)非常活泼的金属冶炼方法选择电解法,高中阶段需要掌握的钠、镁、铝是通过电解法获得;所以选bd,(2)辉铜矿(Cu2S)可发生反应2Cu2S+2H2SO4+5O2=4CuSO4+ 2H2O,Cu2S中铜元素+1价,硫元素-2价,CuSO4中铜元素+2价,硫元素-6价,化合价升高被氧化,做还原剂,氧气做氧化剂,得失电子守恒,1摩尔氧气化合价由0价降到-2价,化合价共降低4,所以还原剂此时失电子的物质的量为4摩尔,CuSO4溶液显酸性,镁和氢离子反应生成氢气。3)为处理银器表面的黑斑(Ag2S),将银器置于铝制容器里的食盐水中并与铝接触,Ag2S转化为Ag,是利用原电池原理,用铝置换出银,食盐水的作用为做电解质溶液,形成原电池。(4)某化学小组在实验中用浓硝酸和铜反应制取二氧化氮并探究二氧化氮是否能支持木炭的燃烧,首先反应制的二氧化氮,其中混有水蒸气,用浓硫酸干燥,然后再检验,导气管均为长进短出,最后用氢氧化钠吸收多余的二氧化氮,防止污染环境。 |
相似问题
重铬酸钠俗称红矾钠(Na2Cr2O7·2H2O)是重要的化工产品和强氧化剂。工业上通过煅烧铬铁矿制取
重铬酸钠俗称红矾钠(Na2Cr2O7·2H2O)是重要的化工产品和强氧化剂。工业上通过煅烧铬铁矿制取,其反应如下:反应Ⅰ 4Fe(CrO2)2+8Na2CO3+7O2 → 2Fe2O
过氧化氢俗名双氧水 医疗上利用它有杀菌消毒作用来清洗伤口。关于双氧水 回答下列问题:A.Na2O2
过氧化氢俗名双氧水,医疗上利用它有杀菌消毒作用来清洗伤口。关于双氧水,回答下列问题:A.Na2O2 + 2HCl =" 2NaCl" + H2O2B.Ag2O + H2O2 ="
ClO2是一种杀菌消毒效率高 二次污染小的水处理剂。下列反应可制得ClO2:2KClO3+H2C2O
ClO2是一种杀菌消毒效率高、二次污染小的水处理剂。下列反应可制得ClO2:2KClO3+H2C2O4+H2SO42ClO2↑+K2SO4+2CO2↑+2H2O下列判断正确的是A.KClO3在
(12分)已知反应:①SO3+H2O===H2SO4 ②3NO2+H2O===2HNO3+NO③2F
(12分)已知反应:①SO3+H2O===H2SO4、②3NO2+H2O===2HNO3+NO③2F2+2H2O===4HF+O2、④2Na+2H2O===2NaOH+H2↑、⑤Na2O+2HCl===2NaCl+H2O、⑥SiO2
下列有关氧化还原反应的说法正确的是A.浓盐酸在化学反应中既可以做氧化剂 又可以作还原剂B.工业上常以
下列有关氧化还原反应的说法正确的是A.浓盐酸在化学反应中既可以做氧化剂,又可以作还原剂B.工业上常以SiO2为原料制取粗硅,这一过程中,硅元素被氧化C












