(16分)(1)(6分)测定Na2O和Na的混合物中金属钠的质量分数可用下图所示的几套仪器组合:①用
(16分)(1)(6分)测定Na2O和Na的混合物中金属钠的质量分数可用下图所示的几套仪器组合: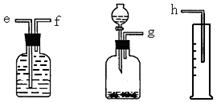 ①用接口字母标出各仪器连接的顺序 量筒在实验中的作用是 ②有一块表面氧化成Na2O的金属钠,其质量为2.0g,实验后在量筒中收集到0.224L水,求样品中金属钠的质量分数是 。(假设在标准状况下测定) (2)(10分) HNO2是一种弱酸,且不稳定,易分解生成NO和NO2;它能被常见的强氧化剂氧化;在酸性溶液中它也是一种氧化剂,如能把Fe2+氧化成Fe3+。AgNO2是一种难溶于水、易溶于酸的化合物。试回答下列问题: ①人体正常的血红蛋白含有Fe2+。若误食亚硝酸盐(如NaNO2),则导致血红蛋白中的Fe2+转化为Fe3+而中毒,服用维生素C可解毒。下列叙述不正确的是________(填序号)。 A.亚硝酸盐被还原 B.维生素C具有还原性 C.维生素C将Fe3+还原为Fe2+ D.在上述变化中亚硝酸盐是还原剂 ②下列方法中,不能用来区分NaNO2和NaCl两种溶液的是________(填序号)。 A.测定这两种溶液的pH B.分别在两种溶液中滴加甲基橙 C.在酸性条件下加入KI—淀粉溶液来区别 D.用AgNO3和HNO3两种试剂来区别 ③某同学把新制的氯水加到NaNO2溶液中,观察到氯水褪色,同时生成NaNO3和HCl,请写出反应的离子方程式:___________________________________。 ④ Fe与过量稀硫酸反应可以制取FeSO4。若用反应所得的酸性溶液,将Fe2+转化为Fe3+,要求产物纯净,可选用的最佳试剂是________(填序号)。 a.Cl2 b.Fe c.H2O2 d.HNO3 ⑤配平下列方程式:  |
参考解答
| (1)① g- f-e-h ;测量气体的体积② 23.0% (2)① D ② B ③ NO2- + Cl2 + H2O ='=' NO3- +2H+ +2Cl- ④ C ⑤ 2、16、3、2、6、6、8 |
| (1)①钠溶于水生成氢气,因此可通过测量氢气的体积来计算钠的物质的量,所以正确的顺序是g- f-e-h。因此量筒的作用是测量气体的体积。 ②在量筒中收集到0.224L水,则生成氢气是0.01mol,因此钠的物质的量是0.02mol,质量是0.46g,所以钠的质量分数是0.46÷2.0=0.23,即质量分数是23%。 (2)服用维生素C可解毒,这说明维生素C能把铁离子还原生成亚铁离子,所以维生素C具有还原性,选项ABC都是正确的,选项D不正确,答案选D。 (3)亚硝酸钠溶于水水解显碱性,而氯化钠溶于水显中性,选项A正确;甲基橙的变色范围是3.1~4.4,所以两种溶液都显黄色,选项B不正确;亚硝酸钠具有氧化性,能把碘化钾氧化生成单质碘,碘遇淀粉显蓝色,选项C正确;亚硝酸银不能溶于水,但能溶液硝酸中,而氯化银不能溶液硝酸中,所以选项D正确,答案选B。 (4)观察到氯水褪色,说明氯水beu还原,所以方程式是NO2- + Cl2 + H2O ='=' NO3- +2H+ +2Cl-。 (5)ad都能氧化亚铁离子,但能引入新的杂质,铁不能氧化亚铁离子,双氧水的还原产物是水,不引入杂质,所以正确额的答案选C。 (6)根据方程式可知,铁元素的化合价从+3价升高到+6价,失去3个电子;氯元素的化合价从0价降低到-1价,得到1个电子,所以根据电子的得失守恒和质量守恒定律可知,配平后的化学计量数依次是2、16、3、2、6、6、8。 |
相似问题
(14分)(1)服用含碘化钾的碘药片可抗核辐射。将碘片剥去糖衣皮研粹后置于试管中制得无色水溶液 并加
(14分)(1)服用含碘化钾的碘药片可抗核辐射。将碘片剥去糖衣皮研粹后置于试管中制得无色水溶液,并加入几滴淀粉试液,然后向试管中逐滴加入氯水,观察
将适量的SO2通过入Fe(NO3)3溶液中 溶液由棕黄色变为浅绿色 但立即又变为棕黄色 继续滴入Ba
将适量的SO2通过入Fe(NO3)3溶液中,溶液由棕黄色变为浅绿色,但立即又变为棕黄色,继续滴入BaCl2溶液,产生白色沉淀。在上述一系列变化过程中,最终被
氰化物有剧毒 在碱性条件下可用如下方法进行处理:2CN-+120H-+5Cl2=2CO32-+N2+
氰化物有剧毒,在碱性条件下可用如下方法进行处理:2CN-+120H-+5Cl2=2CO32-+N2+10Cl-+6H20,则下列判断中,不正确的是A.上述反应中的氧化剂是Cl2B.该反
某一反应体系中 有反应物和生成物共六种物质 这六种物质是:Cl2 KMnO4 MnCl2 H2O H
某一反应体系中,有反应物和生成物共六种物质,这六种物质是:Cl2、KMnO4、MnCl2、H2O、HCl(浓)、KCl,其中Cl2、H2O均为生成物。(1)该反应中的氧化剂是,
黄铜矿(CuFeS2)是制取铜及其化合物的主要原料之一 还可制备硫及铁的化合物。(1)冶炼铜的反应为
黄铜矿(CuFeS2)是制取铜及其化合物的主要原料之一,还可制备硫及铁的化合物。(1)冶炼铜的反应为: 8CuFeS2+21O28Cu+4FeO+2Fe2O3+16SO2若CuFeS2中Fe












