(1)请完成该反应的离子方程式: C + MnO4- + H+ — CO
| (1)请完成该反应的离子方程式: C + MnO4- + H+ — CO2↑+ Mn2+ + H2O (2)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中。进行反应CO(g ) + H2O(g)  CO2(g) + H2(g)得到如下两组数据: CO2(g) + H2(g)得到如下两组数据:
①实验1从开始到达到化学平衡时,以v(CO2)表示的反应速率为 。(精确到0.01) ②该反应为 (填“吸”或“放”)热反应,实验2中达平衡时 CO的转化率为 。 (3)在容积可变的密闭容器中发生反应:mA(g) + nB(g)  pC(g) ,在一定温度和不同压强下达到平衡时,分别得到A的物质的量浓度如下表 pC(g) ,在一定温度和不同压强下达到平衡时,分别得到A的物质的量浓度如下表
①当压强从2×105 Pa增加到5×105 Pa时,平衡 移动(填:向左, 向右 ,不) ②当压强从5×105 Pa增加到1×106 Pa时,该反应平衡常数表达式为K= 。⑷在25℃下,向浓度为0.1mol·L-1的FeCl3溶液中逐滴加入氨水,调节溶液pH为 5时,溶液中c(Fe3+)为 mol/L 。(已知25℃时 Ksp[Fe(OH)3]=4×10-38) | |||||||||||||||||||||||||||||||||
参考解答
| (1)①5 C + 4 MnO4- + 12 H+ = 5 CO2↑+ 4 Mn2+ + 6 H2O (2)①0.13 mol·L-1 ·min-1; ②放 ; 20% (3)①不; ② 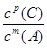 . . (4)4×10-11 |
试题分析:(1)①反应中MnO4-→Mn2+,锰元素化合价由+7价降低为+2价,共降低5价,C→CO2,碳元素化合价由0价升高为+4,共升高4价,化合价最小公倍数为20,故MnO4-系数为4,C系数为5,再根据元素守恒可知Mn2+系数为4、CO2系数为5,根据电荷守恒可知H+系数为12,根据氢元素守恒可知H2O系数为6,配平后离子方程式为5 C + 4 MnO4- + 12 H+ ='=' 5 CO2↑+ 4 Mn2+ + 6 H2O,答案:5 C + 4 MnO4- + 12 H+ ='=' 5 CO2↑+ 4 Mn2+ + 6 H2O。 (2)①、由表中数据可知,CO的物质的量变化量为4mol-2.4mol=1.6mol,v(CO)= 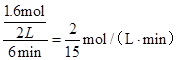 ,速率之比等于化学计量数之比,故v(CO2)=v(CO)= ,速率之比等于化学计量数之比,故v(CO2)=v(CO)=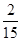 mol/(L·min)=0.13mol/(L·min), mol/(L·min)=0.13mol/(L·min),故答案为:0.13mol/(L·min); ②、实验1中CO的转化率为×100%=40%,实验2中CO的转化率为×100%=20%,则实验1的转化率大于实验2,则说明温度升高平衡向逆反应方向移动,正反应放热, 故答案为:放热; 平衡时CO的物质的量为1.6mol,则: CO(g)+H2O(g)  CO2(g)+H2(g), CO2(g)+H2(g),开始(mol):2 1 0 0 变化(mol):0.4 0.4 0.4 0.4 平衡(mol):1.6 0.6 0.4 0.4 实验2中达平衡时 CO的转化率为 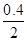 ×100%=20% ×100%=20%答案:①0.13 mol·L-1 ·min-1; ② 放 ; 20% (3) ①压强从2×105Pa增加到5×105 Pa时,A的浓度应变化为0.08mol·L-1的2.5倍即为0.20mol·L-1,而图表中变化为0.20mol·L-1,说明平衡不移动,加压时生成物A浓度增大的倍数等于压强增大的倍数; ②压强从2×105 Pa 增加到1×106 Pa时,A的浓度应变化为0.08mol·L-1的5倍即0.40mol·L-1,而图表中A的浓度为0.44mol·L-1,说明平衡逆向进行;根据①可知反应是气体体积增大的反应,所以此时B加压变为液体或固体,当压强从5×105 Pa增加到1×106 Pa时,该反应平衡常数表达式为K= 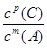 故答案为:①不; ② 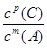 . . (4 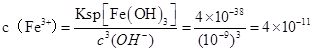 ,答案:4×10-11 ,答案:4×10-11 |
相似问题
用48 mL 0.1 mol/L的 FeSO4溶液 恰好还原1.2×10-3 mol [RO(OH)
用48 mL 0 1 mol L的 FeSO4溶液,恰好还原1 2×10-3 mol [RO(OH)2]+,则R元素的最终价态为( )A.-1价B.0价C.+1价D.+2价
在5NH4NO32HNO3+9H2O+4N2↑反应中 被还原的氮原子与被氧化的氮原子数目比为A.3∶
在5NH4NO32HNO3+9H2O+4N2↑反应中,被还原的氮原子与被氧化的氮原子数目比为A.3∶5B.5∶3C.5∶2D.2∶1
将0.2mol的Cu2S跟足量稀HNO3反应 生成Cu(NO3)2 H2SO4 NO和H2O 则参加
将0 2mol的Cu2S跟足量稀HNO3反应,生成Cu(NO3)2、H2SO4、NO和H2O,则参加反应的HNO3中被还原的HNO3的物质的量是A.0 4 3 molB.2 3 molC.0 8 molD.2 mol
用下列方法制取氧气:①KMnO4受热分解 ②KClO3受热分解(用MnO2作催化剂) ③2H2O22
用下列方法制取氧气:①KMnO4受热分解②KClO3受热分解(用MnO2作催化剂)③2H2O22H2O+O2↑④2Na2O2+2H2O===4NaOH+O2↑若要制得相同质量的氧气,上述四种方
(12分)氧化还原是一类重要的反应。(1)已知反应:①Cu+2Fe3+=Cu2++2Fe2+ ②Cu
(12分)氧化还原是一类重要的反应。(1)已知反应:①Cu+2Fe3+=Cu2++2Fe2+,②Cu2++Fe=Cu+Fe2+反应①中还原剂是,两个反应中各种离子的氧化性从强到












