用下列方法制取氧气:①KMnO4受热分解 ②KClO3受热分解(用MnO2作催化剂) ③2H2O22
| 用下列方法制取氧气: ①KMnO4受热分解 ②KClO3受热分解(用MnO2作催化剂) ③2H2O2 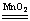 2H2O+O2↑ ④2Na2O2+2H2O===4NaOH+O2↑ 2H2O+O2↑ ④2Na2O2+2H2O===4NaOH+O2↑若要制得相同质量的氧气,上述四种方法中所转移的电子数目之比是
|
参考解答
| B |
| 反应①②中氧元素都是从-2价升高到0价,转移2个电子,反应③④中氧元素的化合价都是从-1价升高到0价,转移1个电子,所以四种方法中所转移的电子数目之比是2∶2∶1∶1,答案选B。 |
相似问题
(12分)氧化还原是一类重要的反应。(1)已知反应:①Cu+2Fe3+=Cu2++2Fe2+ ②Cu
(12分)氧化还原是一类重要的反应。(1)已知反应:①Cu+2Fe3+=Cu2++2Fe2+,②Cu2++Fe=Cu+Fe2+反应①中还原剂是,两个反应中各种离子的氧化性从强到
24ml 0.05mol·L-1的Na2SO3溶液恰好与20ml 0.02mol·L-1的K2Cr2
24ml 0 05mol·L-1的Na2SO3溶液恰好与20ml 0 02mol·L-1的K2Cr2O7溶液完全反应,则元素Cr在还原产物中的化合价为( )A.+5B.+2C.+4D.+3
制取漂白液的化学方程式是:Cl2+2NaOH=NaCl+NaClO+H2O 该反应的氧化剂与还原剂物
制取漂白液的化学方程式是:Cl2+2NaOH=NaCl+NaClO+H2O,该反应的氧化剂与还原剂物质的量之比为A.1:1B.1:2C.2:1D.3:2
在放电条件下 氮气与氧气可直接化合:N2+O22NO。该反应中 氧化剂是________(填化学式)
在放电条件下,氮气与氧气可直接化合:N2+O22NO。该反应中,氧化剂是________(填化学式),若反应中消耗了1 mol N2,则转移_______mol电子。
M2O7 x- 和S 2- 离子在酸性溶液中发生如下反应:M2O7x- +3S2- +14H+ =
M2O7 x- 和S 2- 离子在酸性溶液中发生如下反应:M2O7x- +3S2- +14H+ =2M3+ +3S↓+7H2O,则M2O7x- 离子中M元素的化合价是()A.+2B.+3C.+4D.+6












