(10分) 铜和浓硫酸发生反应的化学方程式为: Cu +2H2SO4(浓) CuSO4+SO2↑+2
| (10分) 铜和浓硫酸发生反应的化学方程式为: Cu +2H2SO4(浓) 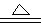 CuSO4+SO2↑+2H2O CuSO4+SO2↑+2H2O(1)浓H2SO4作_________剂,具有 性,氧化产物是 (写化学式)。 (2)在该反应中,若消耗了32 g Cu,则转移了_______mol 电子 ,还原了 mol H2SO4,生成 L SO2(标准状况)气体。 (3)Cu与SO2的还原性由强到弱的顺序为:Cu SO2(填“>”、“<”或“=”)。 |
参考解答
| (10分)(1)氧化,氧化,CuSO4 (每空1分) (2)1 0.5 11.2 (每空2分) (3)> (1分) |
试题分析:(1)硫酸中S元素的化合价从+6价降低到+4价,得到2个电子,所以硫酸是氧化剂,具有氧化性。铜的化合价从0价升高到+2价,失去2个电子,作还原剂,所以氧化产物就是硫酸铜。 (2)32g的物质的量是32g÷64g/mol=0.5mol,则失去0.5mol×2=1.0mol电子;根据电子的得失守恒可知,被还原的硫酸的物质的量是1.0mol÷2=0.5mol,所以生成的SO2就是0.5mol,所以在标准状况下的体积是0.5mol×22.4L/mol=11.2L。 (3)由于在氧化还原反应中,还原剂的还原性强于还原产物的,所以铜的还原性强于SO2的。 点评:该题是高考中的常见题型,本题难度不大,试题基础性强,学生不难得分。该题的关键是理解有关的概念,其次要准确标出有关元素的化合价变化情况,然后依据有关的概念灵活分析、判断即可。 |
相似问题
用硫酸铁电化浸出黄铜矿精矿工艺中 精矿在阳极浸出的反应比较复杂 其中有一主要反应:CuFeS2+4F
用硫酸铁电化浸出黄铜矿精矿工艺中,精矿在阳极浸出的反应比较复杂,其中有一主要反应:CuFeS2+4Fe3+=Cu2++5Fe2++2S下列说法正确的是( )A.反应
氧化还原反应规律是化学学科的重要规律之一。按要求回答下列问题:(1) 被称为万能还原剂的NaBH4溶
氧化还原反应规律是化学学科的重要规律之一。按要求回答下列问题:(1) 被称为万能还原剂的NaBH4溶于水并和水反应:NaBH4+2H2O=NaBO2+4H2↑,此反应中B
将高碘酸H5IO6加入MnSO4溶液中可使溶液呈紫红色 已知H5IO6在反应中发生如下过程:H5IO
将高碘酸H5IO6加入MnSO4溶液中可使溶液呈紫红色,已知H5IO6在反应中发生如下过程:H5IO6→HIO3。完成下列填空:(1)将该反应的氧化剂、还原剂及配平后的
近日来 “巨能钙”事件沸沸扬扬 原因在于部分巨能钙被检出含有双氧水 而双氧水有致癌性 可加速人体衰老
近日来,“巨能钙”事件沸沸扬扬,原因在于部分巨能钙被检出含有双氧水,而双氧水有致癌性,可加速人体衰老。因此卫生部已开始加紧调查“巨能钙”事件。
(8分)二氧化硒(Se)是一种氧剂 其被还原后的单质硒可能成为环境污染物 通过与浓HNO3或浓H2S
(8分)二氧化硒(Se)是一种氧剂,其被还原后的单质硒可能成为环境污染物,通过与浓HNO3或浓H2SO4反应生成SeO2以回收Se。完成下列填空:(1)Se和浓HNO3反












