将高碘酸H5IO6加入MnSO4溶液中可使溶液呈紫红色 已知H5IO6在反应中发生如下过程:H5IO
| 将高碘酸H5IO6加入MnSO4溶液中可使溶液呈紫红色,已知H5IO6在反应中发生如下过程:H5IO6→HIO3。完成下列填空: (1)将该反应的氧化剂、还原剂及配平后的系数填入正确位置。 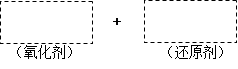 (2)在上图中标明电子转移的方向和数目。 (3)若向H5IO6溶液中加入足量的下列物质,能将碘元素还原成碘离子的是____(选填序号)。 a. 盐酸 b. 硫化氢 c. 溴化钠 d. 硫酸亚铁 (4)若向含1mol H5IO6的溶液中加入过量的过氧化氢溶液,再加入淀粉溶液,溶液变蓝,同时有大量气体产生。请写出此反应的化学方程式:________________________________,此过程中至少可得到气体_________L(标准状态下)。 |
参考解答
(本题共8分)(1)—(2)(共3分,物质1分、配平1分、方向数目1分)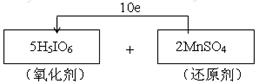 (3)b(1分); (4)2H5IO6 + 7H2O2 → I2 + 12H2O + 7O2↑(2分),78.4L(2分) |
试题分析:(1)—(2)高碘酸H5IO6加入MnSO4溶液中可使溶液呈紫红色,这说明反应中有高锰酸钾生成,因此高碘酸是氧化剂,硫酸锰是还原剂。其中I元素的化合价从+7价降低到+5价,得到2个电子。Mn元素的化合价从+2价升高到+7价,失去5个电子,所以根据电子得失守恒可知,氧化剂与还原剂的物质的量之比是5:2,因此电子转移的方向和数目为 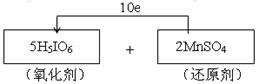 。 。(3)由于氯气、单质溴以及铁离子的氧化性均强于单质碘的,所以选项acd不可能将高碘酸还原为碘离子。单质碘的氧化性强于S的,因此H2S可以把高碘酸还原为碘离子,答案选b。 (4)向含1mol H5IO6的溶液中加入过量的过氧化氢溶液,再加入淀粉溶液,溶液变蓝,这说明有单质碘生成。同时有大量气体产生,该气体应该是氧气,所以反应的化学方程式为2H5IO6 + 7H2O2 → I2 + 12H2O + 7O2↑。其中氧气的物质的量是3.5mol,在标准状况下的体积是3.5mol×22.4L/mol=78.4L。 |
相似问题
近日来 “巨能钙”事件沸沸扬扬 原因在于部分巨能钙被检出含有双氧水 而双氧水有致癌性 可加速人体衰老
近日来,“巨能钙”事件沸沸扬扬,原因在于部分巨能钙被检出含有双氧水,而双氧水有致癌性,可加速人体衰老。因此卫生部已开始加紧调查“巨能钙”事件。
(8分)二氧化硒(Se)是一种氧剂 其被还原后的单质硒可能成为环境污染物 通过与浓HNO3或浓H2S
(8分)二氧化硒(Se)是一种氧剂,其被还原后的单质硒可能成为环境污染物,通过与浓HNO3或浓H2SO4反应生成SeO2以回收Se。完成下列填空:(1)Se和浓HNO3反
固体NH5属离子晶体。它与水反应的方程式为:NH5+H2O=NH3·H2O+H2↑ 它也能跟乙醇发生
固体NH5属离子晶体。它与水反应的方程式为:NH5+H2O=NH3·H2O+H2↑,它也能跟乙醇发生类似的反应,并都产生氢气。下列有关NH5叙述正确的是( ) A.与水反应
食品安全是社会关注的热点。市场上已检测出一些矿泉水中含有高浓度的致癌物“溴酸盐” 而这个“行业秘密”
食品安全是社会关注的热点。市场上已检测出一些矿泉水中含有高浓度的致癌物“溴酸盐”,而这个“行业秘密”在人们的眼皮底下被隐藏了10多年。实验室中制
下列说法正确的是( )A.当7.8 g Na2O2与H2O完全反应时 有0.2 mol电子发生
下列说法正确的是()A.当7 8 g Na2O2与H2O完全反应时,有0 2 mol电子发生了转移B.FeCl2溶液与K3[Fe(CN)6]溶液混合后得到特征蓝色沉淀,利用此反












