(8分)二氧化硒(Se)是一种氧剂 其被还原后的单质硒可能成为环境污染物 通过与浓HNO3或浓H2S
| (8分)二氧化硒(Se)是一种氧剂,其被还原后的单质硒可能成为环境污染物,通过与浓HNO3或浓H2SO4反应生成SeO2以回收Se。 完成下列填空: (1)Se和浓HNO3反应的还原产物为NO和NO2,且NO和NO2的物质的量之比为1:1,写出Se和浓HNO3的反应方式 。 (2)已知:Se+2H2SO4(浓)→2SO2↑+SeO2+2H2O 2SO2+SeO2+2H2O→Se+2SO42-+4H+ SeO2、H2SO4(浓)、SO2的氧化性由强到弱的顺序是 。 (3)回收得到的SeO2的含量,可以通过下面的方法测定: ①SeO2+KI+HNO3  Se+I2+KNO3+H2O Se+I2+KNO3+H2O②I2+2Na2S2O3  Na2S4O6+2NaI Na2S4O6+2NaI配平方程式①,标出电子转移的方向和数目。 (4)实验中,准确称量SeO2样品0.1500g,消耗0.2000 mol·L-1的Na2S2O3溶液25.00 mL,所测定的样品中SeO2的质量分数为 。 |
参考解答
  (1) Se+2HNO3(浓)=H2SeO3+NO↑+NO2↑。 (1) Se+2HNO3(浓)=H2SeO3+NO↑+NO2↑。(2) H2SO4(浓)> SeO2> SO2。 (3) 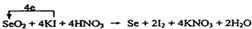 (4) 92.5% |
| 考查氧化还原反应的有关判断和计算等。 (1)根据已知反应物和生成物并根据电子得失守恒和质量守恒定律可知,反应的化学方程式是Se+2HNO3(浓)=H2SeO3+NO↑+NO2↑。 (2)在氧化还原反应氧化剂的氧化性大于氧化产物的,所以根据反应的化学方程式可知,SeO2、H2SO4(浓)、SO2的氧化性由强到弱的顺序是H2SO4(浓)> SeO2> SO2。 (3)在反应①中Se元素的化合价从+4价降低到0价,而碘元素的化合价从-1价升高到0价,所以根据电子的得失守恒,配平后的方程式是 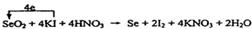 。 。(4)根据反应①②及电子的得失守恒可知,SeO2~4Na2S2O3,所以参加反应的SeO2的物质的量是0.2000 mol·L-1×0.025L/4=0.00125mol,因此所测定的样品中SeO2的质量分数为 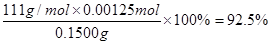 。 。 |
相似问题
固体NH5属离子晶体。它与水反应的方程式为:NH5+H2O=NH3·H2O+H2↑ 它也能跟乙醇发生
固体NH5属离子晶体。它与水反应的方程式为:NH5+H2O=NH3·H2O+H2↑,它也能跟乙醇发生类似的反应,并都产生氢气。下列有关NH5叙述正确的是( ) A.与水反应
食品安全是社会关注的热点。市场上已检测出一些矿泉水中含有高浓度的致癌物“溴酸盐” 而这个“行业秘密”
食品安全是社会关注的热点。市场上已检测出一些矿泉水中含有高浓度的致癌物“溴酸盐”,而这个“行业秘密”在人们的眼皮底下被隐藏了10多年。实验室中制
下列说法正确的是( )A.当7.8 g Na2O2与H2O完全反应时 有0.2 mol电子发生
下列说法正确的是()A.当7 8 g Na2O2与H2O完全反应时,有0 2 mol电子发生了转移B.FeCl2溶液与K3[Fe(CN)6]溶液混合后得到特征蓝色沉淀,利用此反
某稀溶液中含有等物质的量的(均为1mol)ZnSO4 Fe2(SO4)3 H2SO4 CuSO4 向
某稀溶液中含有等物质的量的(均为1mol)ZnSO4、Fe2(SO4)3、H2SO4、CuSO4,向其中逐渐加入铁粉。下列各图表示溶液中的Fe2+的物质的量与加入铁粉的物质的量
在下列变化①大气固氮 ②工业合成氨 ③实验室制取氨气中 按氮元素被氧化 被还原 既不被氧化又不被还原
在下列变化①大气固氮,②工业合成氨,③实验室制取氨气中,按氮元素被氧化、被还原、既不被氧化又不被还原的顺序排列,正确的是( )A.①②③B.②①












