(1)某元素原子的核电荷数是电子层数的5倍 其质子数是最外层电子数的3倍 该元素的原子结构示意图是
| (1)某元素原子的核电荷数是电子层数的5倍,其质子数是最外层电子数的3倍,该元素的原子结构示意图是 。 (2)已知某粒子的结构示意图为: 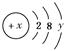 ,试回答: ,试回答:①当x-y=10时,该粒子为 (填“原子”“阳离子”或“阴离子”)。 ②当y=8时,粒子可能为(填名称) 、 、 、 、 。 |
参考解答
(1)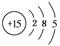 (2)①原子 ②氩原子;氯离子;硫离子;钾离子;钙离子 ③Al(OH)3+3H+=Al3++3H2O ③写出y=3与y=7的元素最高价氧化物对应水化物之间发生反应的离子方程式 。 |
| (1)设该元素原子的核电荷数=质子数=a,电子层数为x,最外层电子数为y,依题意:a=5x,a=3y,则5x=3y。因原子的最外层电子数不超过8,即y为1~8的正整数,故仅当y=5,x=3时合理,该元素的核电荷数为15。(2)①当x-y=10时,x=10+y,说明核电荷数等于核外电子数,所以该粒子应为原子;②当y=8时,应为有18个电子的粒子,所以可能为氩原子、氯离子、硫离子、钾离子、钙离子;③y=3时为铝原子、y=7时为氯原子,其最高价氧化物对应的水化物分别为氢氧化铝和高氯酸,反应的离子方程式为Al(OH)3+3H+=Al3++3H2O。 |
相似问题
有短周期元素A B C 其中A B同周期 B C同主族 且最外层电子数之和为17 核电荷数之和为31
有短周期元素A、B、C,其中A、B同周期,B、C同主族,且最外层电子数之和为17,核电荷数之和为31,则A、B、C为( )。A C、N、Si B N、P、O C N、O、S D C、Si、S
下表为元素周期表前四周期的一部分 下列有关R W X Y Z五种元素的叙述中 正确的是A.常压下五种
下表为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,正确的是A.常压下五种元素的单质中Z单质的沸点最高B.Y、Z的阴离子电子层
A B C D 4种元素的原子序数均小于18 其最高正价依次为+1 +4 +5 +7 已知B的原子核
A、B、C、D 4种元素的原子序数均小于18,其最高正价依次为+1、+4、+5、+7,已知B的原子核外次外层电子数为2。A、C原子的核外次外层电子数为8。D元素的最高
X Y Z是原子序数依次递增的短周期元素 3种元素的原子核外电子数之和与Ca2+的核外电子数相等 X
X、Y、Z是原子序数依次递增的短周期元素,3种元素的原子核外电子数之和与Ca2+的核外电子数相等,X、Z分别得到一个电子后均形成稀有气体原子的稳定电子层
A元素的最高价离子0.5 mol被还原成中性原子时 要得到6.02×1023个电子。它的单质同盐酸充
A元素的最高价离子0 5 mol被还原成中性原子时,要得到6 02×1023个电子。它的单质同盐酸充分反应时,放出0 02 g H2,用去0 4 g A。B元素的原子核外电子












