下表中实线是元素周期表的部分边界 其中上边界并未用实线标出。根据信息回答下列问题。(1)周期表中基态
下表中实线是元素周期表的部分边界,其中上边界并未用实线标出。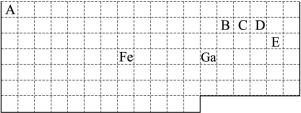 根据信息回答下列问题。 (1)周期表中基态Ga原子的最外层电子排布式为 。 (2)Fe元素位于周期表的 区;Fe与CO易形成配合物Fe(CO)5,在Fe(CO)5中铁的化合价为 ;已知:原子数目和电子总数(或价电子总数)相同的微粒互为等电子体,等电子体具有相似的结构特征。与CO分子互为等电子体的分子和离子分别为 和 (填化学式)。 (3)在CH4、CO2、CH3OH中,碳原子采取sp3杂化的分子有 。 (4)根据VSEPR理论预测ED4-离子的空间构型为 。B、C、D、E原子相互化合形成的分子中,所有原子都满足最外层8电子稳定结构的分子的电子式为 (写2种)。 |
参考解答
(1)4s24p1 (2)d 0 N2 CN- (3)CH4、CH3OH (4)正四面体 CO2、NCl3、CCl4(任写2种即可) |
试题分析:(1)31号元素Ga原子基态的最外层电子排布式为4s24p1。(2)26号元素Fe元素在周期表的位于第四周期第Ⅷ族,位于周期表的d区。Fe与CO易形成配合物Fe(CO)5,在Fe(CO)5中铁的化合价为0价。与CO分子互为等电子体的分子是N2,离子为CN-。(3)在CH4、CO2、CH3OH中,碳原子采取sp3杂化的分子有CH4、CH3OH;CO2中的C原子的杂化方式为sp杂化。(4)根据表格中各种元素的相对位置可以看出:A是H;B是C;C是N;D是O;E是Cl。根据VSEPR理论预测ClO4-离子的空间构型为正四面体型。在C、N、O、Cl原子相互化合形成的分子中,所有原子都满足最外层8电子稳定结构的分子有CO2、NCl3、CCl4,其电子式为 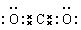 ; ;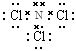 ; ;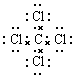 。 。 |
相似问题
(1)某元素原子的核电荷数是电子层数的5倍 其质子数是最外层电子数的3倍 该元素的原子结构示意图是
(1)某元素原子的核电荷数是电子层数的5倍,其质子数是最外层电子数的3倍,该元素的原子结构示意图是。(2)已知某粒子的结构示意图为:,试回答:①当x-y
有短周期元素A B C 其中A B同周期 B C同主族 且最外层电子数之和为17 核电荷数之和为31
有短周期元素A、B、C,其中A、B同周期,B、C同主族,且最外层电子数之和为17,核电荷数之和为31,则A、B、C为( )。A C、N、Si B N、P、O C N、O、S D C、Si、S
下表为元素周期表前四周期的一部分 下列有关R W X Y Z五种元素的叙述中 正确的是A.常压下五种
下表为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,正确的是A.常压下五种元素的单质中Z单质的沸点最高B.Y、Z的阴离子电子层
A B C D 4种元素的原子序数均小于18 其最高正价依次为+1 +4 +5 +7 已知B的原子核
A、B、C、D 4种元素的原子序数均小于18,其最高正价依次为+1、+4、+5、+7,已知B的原子核外次外层电子数为2。A、C原子的核外次外层电子数为8。D元素的最高
X Y Z是原子序数依次递增的短周期元素 3种元素的原子核外电子数之和与Ca2+的核外电子数相等 X
X、Y、Z是原子序数依次递增的短周期元素,3种元素的原子核外电子数之和与Ca2+的核外电子数相等,X、Z分别得到一个电子后均形成稀有气体原子的稳定电子层












