I.根据反应3Cu+8HNO3 3Cu(NO3)2+2NO↑+4H2O 回答下列问题:(1)氧化剂
| I.根据反应3Cu+8HNO3 (1)氧化剂是 , 元素被氧化; (2)用“双线桥”表示该反应电子转移的方向和数目: 3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O (3)当有2 mol HNO3被还原时,被氧化的物质的质量为 ,转移的电子数为 ; II. 有下列6种物质:K2SO4、K2SO3、I2、H2SO4、KIO3、H2O组成一个氧化还原反应,已知在反应中K2SO3失去电子。请将这6种物质组成一个化学方程式(需配平): 2002年9月26日,中国北京曙光公司研制出了第一款具有我国完全自主知识产权的高性能CPU 芯片— “龙芯”1号。该芯片中主要成分可以制成计算机长距离联网传输的线路材料,这种埋在地下的材 料如果裸露在碱性土壤中,结果会断路,用离子方程式说明原因 |
参考解答
| Ⅰ、(1) HNO3 Cu (2) 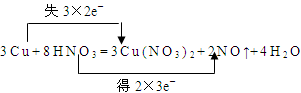 (3)192g 6NA或3.612×1024 Ⅱ、2KIO3+5K2SO3+H2SO4=6K2SO4+I2+H2O Ⅲ、SiO2+2OH-=SiO32-+H2O |
试题分析:Ⅰ(1)氧化剂反应中的电子,化合价降低的元素,所以硝酸是氧化剂,铜被氧化; (2)反应中铜共失去3×2e-,氮元素共得到2×3e-,双线桥如下:  (3)当有2 mol HNO3被还原时,即有2molN被还原,转移电子数为6NA,被氧化的物质Cu3mol,质量是192g; Ⅱ已知在反应中K2SO3失去电子,说明K2SO3作还原剂,根据氧化还原反应原理,只能是KIO3作氧化剂,结合一般情况下酸性越强氧化剂的氧化性越强,可知硫酸为反应物,所以组成的方程式为2KIO3+5K2SO3+H2SO4=6K2SO4+I2+H2O Ⅲ计算机长距离联网传输的线路材料的主要成分是二氧化硅,在碱性土壤中易变质成为硅酸盐而断路,离子方程式为SiO2+2OH-=SiO32-+H2O |
相似问题
(1)如图是课本中“四种基本反应类型与氧化还原反应的关系”图 “H2+CuO Cu+H2O”反应属于
(1)如图是课本中“四种基本反应类型与氧化还原反应的关系”图,“H2+CuO Cu+H2O”反应属于图中的区域(填序号)。下列反应中属于区域7的有。A.2H2+O2
【化学——选修化学与技术】(15分)现有一种以黄铜矿和硫磺为原料制取铜和其他产物的新工艺 原料的综合
【化学——选修化学与技术】(15分)现有一种以黄铜矿和硫磺为原料制取铜和其他产物的新工艺,原料的综合利用率较高。其主要流程如下:注:反应Ⅱ的离子
常温下 将等浓度的FeSO4和(NH4) 2SO4两种浓溶液混合可制得一种晶体 该晶体是分析化学中常
常温下,将等浓度的FeSO4和(NH4) 2SO4两种浓溶液混合可制得一种晶体,该晶体是分析化学中常用的一种还原剂,其强热分解反应化学方程式:2(NH4)2Fe(SO4)2
甲 乙两同学研究Na2SO3溶液与FeCl3溶液反应的情况。步骤操作现象I向2 mL 1 mol·L
甲、乙两同学研究Na2SO3溶液与FeCl3溶液反应的情况。步骤操作现象I向2 mL 1 mol·L-1FeCl3溶液中加入一定量的Na2SO3溶液溶液由棕黄色变为红褐色,并有
部分弱酸的电离平衡常数如下表:弱酸HCOOHHClOH2CO3H2SO3电离平衡常数(25℃) (1
部分弱酸的电离平衡常数如下表:弱酸HCOOHHClOH2CO3H2SO3电离平衡常数(25℃)(1)在温度相同时,各弱酸的Ki值与酸性的相对强弱的关系为:_____________












