(7分)已知Ca(OH)2与Cl2反应的氧化产物与温度有关 在一定量的石灰乳中通入一定量的氯气 二者
(7分)已知Ca(OH)2与Cl2反应的氧化产物与温度有关,在一定量的石灰乳中通入一定量的氯气,二者恰好完全反应(发生的反应均为放热反应)。生成物中含有Cl 、ClO 、ClO 、 、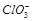 ;三种含氯元素的离子,其中C1O ;三种含氯元素的离子,其中C1O 、 、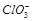 两种离子的物质的量(n)与反应时间(t)的曲线如右图所示。 两种离子的物质的量(n)与反应时间(t)的曲线如右图所示。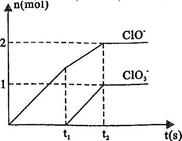 (1)t1前,氧化产物是 (填化学式)。 (2)t2时,Ca(OH)2与Cl2发生反应的总的离子方程式为: (3)该石灰乳中含有Ca(OH)2的物质的量是 mol (4)NaClO2较稳定,但加热或敲击亚氯酸钠固体时立即爆炸,其爆炸后的产物可能是 (填字母)。
 + OH + OH ———— ———— 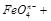  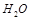 |
参考解答
| (1)Ca(ClO)2 (1分) (2) 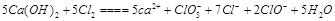 (2分) (2分)(3)5 (1分) (4)D (1分) (5)2, (5-n), 2n, (5-n) (n+3) (2分) |
试题分析:(1)Ca(ClO)2;t1时间,Cl2只有失去电子生成了ClO- (2) 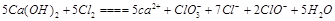 根据得失电子守恒进行配平,最后ClO-与ClO3-的比例符合2比1。生成物根据元素守恒判断,氯气的价态即能升高到+1价和+3价,还有降低到-1价,所以生成了Cl-。 根据得失电子守恒进行配平,最后ClO-与ClO3-的比例符合2比1。生成物根据元素守恒判断,氯气的价态即能升高到+1价和+3价,还有降低到-1价,所以生成了Cl-。(3)根据方程式计算,有图像可知ClO-为2mol ,最后氯气过量,所以Ca(OH)2的物质的量是5mol。 (4)NaClO2中氯的价态是+3价,发生歧化反应,即升高价态生成 NaClO3又降低价态生成NaCl。 (5)根据得失电子守恒来配平,首先标出生成物 FeO4n-中Fe的价态为8-n,所以Fe变化的价态为8-n-3,即5-n。反应物中氯的价态为+1价,生成的氯为-1价,所以变化的价态为2,取最小公倍数2(5-n),所以反应物种氢氧化铁前面配2,氯气前面配(5-n),ClO-前面配(5-n)。最后根据O元素守恒,H元素守恒,OH  前面配2n, 前面配2n,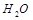 前面配n+3。 前面配n+3。点评:本题考查比较综合,难点在于离子反应方程式的书写,以及利用氧化还原反应中得失电子守恒的原理。 |
相似问题
汽车安全气囊是汽车安全性辅助配置之一。汽车剧烈碰撞时 安全气囊中发生反应:10NaN3 +2KNO3
汽车安全气囊是汽车安全性辅助配置之一。汽车剧烈碰撞时,安全气囊中发生反应:10NaN3 +2KNO3 ==K2O+5Na2O+16N2↑,则下列判断不正确的是A.NaN3是
(6分) 氯气在生产生活中应用广泛。(1)工业上可用MnSO4溶液吸收氯气 获得Mn2O3 Mn2O
(6分) 氯气在生产生活中应用广泛。(1)工业上可用MnSO4溶液吸收氯气,获得Mn2O3,Mn2O3广泛应用于电子工业、印染工业等领域。请写出该化学反应的化学方程
某溶液中Cl- Br- I-三者物质的量之比为2︰3︰4 要使溶液中Cl- Br- I-物质的量之比
某溶液中Cl-、Br-、I-三者物质的量之比为2︰3︰4,要使溶液中Cl-、Br-、I-物质的量之比为1︰1︰1,则通入Cl2的物质的量是原溶液中I-物质的量的A.
浓盐酸和氯酸钾的反应如下:KClO3 + 6HCl KCl + 3Cl2 ↑ + 3H2O其中发生氧
浓盐酸和氯酸钾的反应如下:KClO3 + 6HCl KCl + 3Cl2 ↑+ 3H2O其中发生氧化反应的氯原子和发生还原反应的氯原子的质量比是 A.1∶6B.1∶5C.5∶1D.6∶1
制备粗硅的反应为:SiO2+2C Si+2CO↑ 其中氧化剂与还原剂的物质的量之比为A.1 : 3B
制备粗硅的反应为:SiO2+2C Si+2CO↑,其中氧化剂与还原剂的物质的量之比为A.1 : 3B.1 : 2C.3 : 1D.2 : 1












