(6分) 氯气在生产生活中应用广泛。(1)工业上可用MnSO4溶液吸收氯气 获得Mn2O3 Mn2O
| (6分) 氯气在生产生活中应用广泛。 (1)工业上可用MnSO4溶液吸收氯气,获得Mn2O3,Mn2O3广泛应用于电子工业、印染工业等领域。请写出该化学反应的化学方程式 。 (2)海底蕴藏着丰富的锰结核矿,其主要成分是MnO2 。1991年由Allen等人研究,用硫酸淋洗后使用不同的方法可制备纯净的MnO2,其制备过程如下图所示: 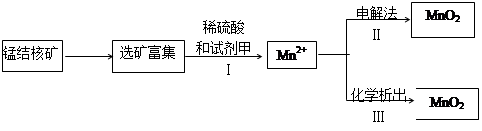 ①步骤I中,试剂甲必须具有的性质是 (填序号)。 a. 氧化性 b.还原性 c.酸性 ②步骤Ⅲ中,以NaClO3为氧化剂,当生成0.050 mol MnO2时,消耗0.10 mol·L-1的NaClO3溶液200 mL ,该反应的离子方程式为________________。 |
参考解答
| (1) 2MnSO4+Cl2+3H2O='=' Mn2O3+2H2SO4+2HCl(2分) (2)① b(1分) ② 2ClO3-+5Mn2++4H2O=5MnO2+Cl2↑+8H+(3分) |
试题分析:(1) 氯气与MnSO4溶液反应,氯气作为氧化剂,MnSO4被氧化为Mn2O3,方程式为:2MnSO4+Cl2+3H2O='=' Mn2O3+2H2SO4+2HCl; (2)MnO2具有强氧化性,转化为锰离子,说明加入的物质具有还原性;当把锰离子转化为二氧化锰,生成0.050 mol MnO2,失去0.1mol电子,消耗0.020 molNaClO3,得到0.1mol电子,则1个NaClO3得到5个电子,即1个Cl降低5价,生成的应该是Cl2,反应如下:2ClO3-+5Mn2++4H2O=5MnO2+Cl2↑+8H+。 点评:根据题给信息书写氧化还原反应方程式是学生的难点,本题难度较大。 |
相似问题
某溶液中Cl- Br- I-三者物质的量之比为2︰3︰4 要使溶液中Cl- Br- I-物质的量之比
某溶液中Cl-、Br-、I-三者物质的量之比为2︰3︰4,要使溶液中Cl-、Br-、I-物质的量之比为1︰1︰1,则通入Cl2的物质的量是原溶液中I-物质的量的A.
浓盐酸和氯酸钾的反应如下:KClO3 + 6HCl KCl + 3Cl2 ↑ + 3H2O其中发生氧
浓盐酸和氯酸钾的反应如下:KClO3 + 6HCl KCl + 3Cl2 ↑+ 3H2O其中发生氧化反应的氯原子和发生还原反应的氯原子的质量比是 A.1∶6B.1∶5C.5∶1D.6∶1
制备粗硅的反应为:SiO2+2C Si+2CO↑ 其中氧化剂与还原剂的物质的量之比为A.1 : 3B
制备粗硅的反应为:SiO2+2C Si+2CO↑,其中氧化剂与还原剂的物质的量之比为A.1 : 3B.1 : 2C.3 : 1D.2 : 1
含有a mol FeBr2的溶液中 通入 x mol Cl2。下列各项为通Cl2过程中 溶液内发生反
含有a mol FeBr2的溶液中,通入 x mol Cl2。下列各项为通Cl2过程中,溶液内发生反应的离子方程式,其中不正确的是A.x=0 4a,2Fe2++Cl2=2Fe3++2
(10分)已知:2Fe3++2I-===2Fe2++I2 2Fe2++Br2===2Fe3++2Br
(10分)已知:2Fe3++2I-===2Fe2++I2,2Fe2++Br2===2Fe3++2Br-。(1)含有1 mol FeI2和2 mol FeBr2的溶液中通入2 mol Cl2,此时被氧化的












