浓盐酸和氯酸钾的反应如下:KClO3 + 6HCl KCl + 3Cl2 ↑ + 3H2O其中发生氧
浓盐酸和氯酸钾的反应如下:KClO3 + 6HCl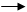 KCl + 3Cl2 ↑ + 3H2O其中发生氧化反应的氯原子和发生还原反应的氯原子的质量比是 KCl + 3Cl2 ↑ + 3H2O其中发生氧化反应的氯原子和发生还原反应的氯原子的质量比是
|
参考解答
| C |
试题分析:根据方程式可知,氯酸钾中氯元素的化合价从+5价降低到0价,得到5个电子,被还原,发生还原反应。氯化钾中氯元素的化合价从-1价升高到0价,失去1个电子,被氧化,发生氧化反应,则根据电子的得失守恒可知,发生氧化反应的氯原子和发生还原反应的氯原子的质量比是5∶1,答案选C。 点评:该题是中等难度的试题的考查,也是高考中的常见考点。试题基础性强,旨在巩固基础,提高学生的应试能力。该题的关键是准确判断出有关元素的化合价变化情况,然后依据有关的概念并结合电子得失守恒进行判断和计算即可,有利于培养学生的逻辑思维能力和发散思维能力。 |
相似问题
制备粗硅的反应为:SiO2+2C Si+2CO↑ 其中氧化剂与还原剂的物质的量之比为A.1 : 3B
制备粗硅的反应为:SiO2+2C Si+2CO↑,其中氧化剂与还原剂的物质的量之比为A.1 : 3B.1 : 2C.3 : 1D.2 : 1
含有a mol FeBr2的溶液中 通入 x mol Cl2。下列各项为通Cl2过程中 溶液内发生反
含有a mol FeBr2的溶液中,通入 x mol Cl2。下列各项为通Cl2过程中,溶液内发生反应的离子方程式,其中不正确的是A.x=0 4a,2Fe2++Cl2=2Fe3++2
(10分)已知:2Fe3++2I-===2Fe2++I2 2Fe2++Br2===2Fe3++2Br
(10分)已知:2Fe3++2I-===2Fe2++I2,2Fe2++Br2===2Fe3++2Br-。(1)含有1 mol FeI2和2 mol FeBr2的溶液中通入2 mol Cl2,此时被氧化的
在100ml含等物质的量的HBr和H2SO3的溶液中通入0.025molCl2 有一半Br-变为Br
在100ml含等物质的量的HBr和H2SO3的溶液中通入0 025molCl2,有一半Br-变为Br2。则原溶液中HBr和H2SO3的浓度都等于( )A.0 16mol LB.0 02mol LC.0 20mol L D.0 25mol?L ̄1
为测定人体血液中Ca2+的含量 设计了如下方案:有关反应的化学方程式为:2KMnO4+5H2C2O4
为测定人体血液中Ca2+的含量,设计了如下方案:有关反应的化学方程式为:2KMnO4+5H2C2O4+3H2SO4K2SO4+2MnSO4+10CO2↑+8H2O。若血液样品为15mL,滴












