(10分)已知:2Fe3++2I-===2Fe2++I2 2Fe2++Br2===2Fe3++2Br
| (10分)已知:2Fe3++2I-===2Fe2++I2,2Fe2++Br2===2Fe3++2Br-。 (1)含有1 mol FeI2和2 mol FeBr2的溶液中通入2 mol Cl2,此时被氧化的离子是____________,被氧化的离子的物质的量分别是________。 (2)如果向原溶液中通入3 mol Cl2,则被氧化的离子是________,其对应的氧化产物的物质的量分别是________。 (3)若向含a mol FeI2和b mol FeBr2的溶液中通入c mol Cl2,当I-、Fe2+、Br-完全被氧化时,c为________(用含a、b的代数式表示)。 |
参考解答
| ( 10分,每空2分) ①I-、Fe2+ 2 mol、2 mol ②I-、Fe2+、Br- 1 mol、3 mol、0.5 mol ③ 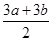 |
| 考查氧化还原反应的应该判断和计算。 (1)在氧化还原反应中还原剂的还原性强于还原产物的,所以还原性强弱顺序是I-、Fe2+、Br-,所以氯气首先氧化的的是I-,然后是Fe2+,最后是Br-。根据电子的得失守恒可知,2mol氯气能氧化2molI-和2molFe2+。 (2)如果氯气是3mol,则根据电子的得失守恒可知,被氧化的离子是2molI-、3molFe2+和1molBr-,所以对应的氧化产物分别是1molI2、3molFe3+和0.5molBr2。 (3)根据电子的得失守恒可知,2c=2a+(a+b)+2b,即c= 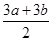 。 。 |
相似问题
在100ml含等物质的量的HBr和H2SO3的溶液中通入0.025molCl2 有一半Br-变为Br
在100ml含等物质的量的HBr和H2SO3的溶液中通入0 025molCl2,有一半Br-变为Br2。则原溶液中HBr和H2SO3的浓度都等于( )A.0 16mol LB.0 02mol LC.0 20mol L D.0 25mol?L ̄1
为测定人体血液中Ca2+的含量 设计了如下方案:有关反应的化学方程式为:2KMnO4+5H2C2O4
为测定人体血液中Ca2+的含量,设计了如下方案:有关反应的化学方程式为:2KMnO4+5H2C2O4+3H2SO4K2SO4+2MnSO4+10CO2↑+8H2O。若血液样品为15mL,滴
已知氧化还原反应反应 K2Cr2O7 + 14HCl='=' 2KCl + 2CrCl3 + 3Cl
已知氧化还原反应反应 K2Cr2O7 + 14HCl="=" 2KCl + 2CrCl3 + 3Cl2+ 7H2O关于该反应的说法中正确的组合是 ①氧化剂是K2Cr2O7 ②还原性:Cl->C
某元素的单质与足量浓HNO3反应时 参加反应的单质与HNO3的物质的量之比为1∶4 则反应后的产物中
某元素的单质与足量浓HNO3反应时,参加反应的单质与HNO3的物质的量之比为1∶4,则反应后的产物中,该元素的价态可能为A.+1B.+5 C.+3D.+4
关注饮用水 保证人民的生活质量。回答下列两个问题:(1)饮用水中的NO3- 对人类健康会产生危害 为
关注饮用水,保证人民的生活质量。回答下列两个问题:(1)饮用水中的NO3-对人类健康会产生危害,为了降低饮用水中NO3-的浓度,可以在碱性条件下用铝粉将












