在100m L含等物质的量的HBr和H2SO3的溶液里通入0.025molCl2 有一半Br-变为
在100m L含等物质的量的HBr和H2SO3的溶液里通入0.025molCl2,有一半Br-变为Br2(已知Br2能氧化H2SO3 )。则原溶液中HBr和H2SO3的浓度都等于( )
|
参考解答
| D |
试题分析:因为Br2能氧化H2SO3,所以H2SO3还原性较强。Cl2应先氧化H2SO3再氧化HBr。设等物质的量的HBr和H2SO3的物质的量为。 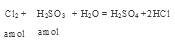 ,充分反应后余下的氯气再和HBr反应。 ,充分反应后余下的氯气再和HBr反应。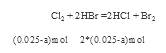 因为有一半Br-变为Br2,所以2*(0.025-a)mol=a/2 。所以可以求出a=0.002mol。可以求解: 因为有一半Br-变为Br2,所以2*(0.025-a)mol=a/2 。所以可以求出a=0.002mol。可以求解: 32->I->Fe2+>Br->Cl-这些离子的还原性的大小顺序。 32->I->Fe2+>Br->Cl-这些离子的还原性的大小顺序。 |
相似问题
(8分)(1)收集一量筒NO2气体 把它倒放在盛水的水槽中 过一会儿气体的颜色由 色变为
(8分)(1)收集一量筒NO2气体,把它倒放在盛水的水槽中,过一会儿气体的颜色由色变为色,水上升到量筒的处,再往量筒里通入少量O2,又出现色。(2) 配平
已知反应:3BrF3+5H2O=Br2+HBrO3+9HF+O2 若生成标准状况下6.72L O2
已知反应:3BrF3+5H2O=Br2+HBrO3+9HF+O2,若生成标准状况下6 72L O2,则被H2O还原的BrF3的物质的量为A.0 3molB.0 4molC.0 6molD.0 9mol
(6分)某反应池中 发生“生物硝化过程” 利用 如果不考虑反应过程中硝化细菌的增殖 其净反应如下式所
(6分)某反应池中,发生“生物硝化过程”,利用,如果不考虑反应过程中硝化细菌的增殖,其净反应如下式所示:(1)完成上述反应的离子方程式并配平,将
(7分) 铜和浓硫酸发生反应的化学方程式为: Cu +2H2SO4(浓) CuSO4+SO2↑+2H
(7分) 铜和浓硫酸发生反应的化学方程式为: Cu +2H2SO4(浓) CuSO4+SO2↑+2H2O(1)浓H2SO4作_________剂,具有性。(2)在该反应中,若消耗了32 g
硫酸铵在强热时分解的产物是二氧化硫.氮气.氨气.水 则该反应化合价变化和未变化的氮原子数之比为A.1
硫酸铵在强热时分解的产物是二氧化硫 氮气 氨气 水,则该反应化合价变化和未变化的氮原子数之比为A.1:4B.1:2C.2:1D.4:1












