肼(N2H4)是火箭发射常用的燃料。(1)最新实验研究用肼还原新制Cu(OH)2可制备纳米级Cu2O
| 肼(N2H4)是火箭发射常用的燃料。 (1)最新实验研究用肼还原新制Cu(OH)2可制备纳米级Cu2O,同时放出N2。请写出该制法的化学反应方程式____________________________,当反应中转移0.2 mol电子 时,可制得Cu2O的质量为__________。 (2)一种以肼(N2H4)为燃料的电池装置如图所示。该燃料电池的电极材料采用多孔导电材料,以提高电极反应物在电极表面的吸附量,并使它们与电解质溶液充分接触,以空气中的氧气作为氧化剂,KOH溶液作为电解质。负极上发生的电极反应为_________________; ②电池工作时产生的电流从_______电极经过负载后流向________电极(填“左侧”或“右侧”)。 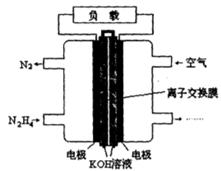 |
参考解答
| (1)N2H4+4Cu(OH)2= 2Cu2O+N2+6H2O 14.4g (2)①N2H4+4OH--4e-=N2+4H2O ② 右侧 左侧 |
试题分析:(1)根据题意可知该反应的方程式为:N2H4+4Cu(OH)2='==' 2Cu2O+N2+6H2O。每产生2摩尔的Cu2O,转移电子4NA。当反应中转移0.2 mol电子时,可制得Cu2O 0.1mol,其质量为0.1mol×144g/mol =14.4g. (2)根据题意可知:在该肼(N2H4)为燃料的电池中,通入肼(N2H4)的电极为负极,通入空气的电极正极。负极的电极反应式为:N2H4+4OH--4e-='==' N2+4H2O,电池工作时电子由负极经过负载到正极,产生的电流则从右侧的电极经过负载后流向左侧的负极。2H4)的性质及在燃料的电池应用的知识。 |
相似问题
对反应3Cl2 + 8NH3== 6 NH4Cl + N 2(1)该反应中的氧化剂是____
对反应3Cl2 + 8NH3== 6 NH4Cl + N 2(1)该反应中的氧化剂是__________ ,被氧化的元素是。(2) 1 mol Cl2参加反应,被氧化的NH3的物质的量
在一定条件下 RO3n-和Cl2可发生如下反应:RO3n-+Cl2+ H2O=RO42-+2Cl-+
在一定条件下,RO3n-和Cl2可发生如下反应:RO3n-+Cl2+ H2O=RO42-+2Cl-+2H+,从而可知在RO3n-中,元素R的化合价是A.+4价B.+5价C.+6价D.+7价
氮化铝(AlN)广泛应用于电子 陶瓷等工业领域。在一定条件下 AlN可在一定条件下合成:Al2O3
氮化铝(AlN)广泛应用于电子、陶瓷等工业领域。在一定条件下,AlN可在一定条件下合成:Al2O3 + N2 + 3C → 2AlN + 3CO。下列叙述正确的是()A
硫酸工厂尾气处理时用NaOH溶液吸收SO2生成NaHSO3 再用NaIO3按下列反应(配平)来制取单
硫酸工厂尾气处理时用NaOH溶液吸收SO2生成NaHSO3,再用NaIO3按下列反应(配平)来制取单质I2。NaIO3来源于自然界的矿物。 ① NaIO3 + NaHSO3— NaI
用KMnO4氧化密度为1.2 g·cm-3 溶质质量分数为36.5%的HCl溶液。反应方程式如下:2
用KMnO4氧化密度为1 2 g·cm-3,溶质质量分数为36 5%的HCl溶液。反应方程式如下:2KMnO4+16HCl===2KCl+2MnCl2+5Cl2↑+8H2O,15 8gKMnO4能使ml HCl












