对反应3Cl2 + 8NH3== 6 NH4Cl + N 2(1)该反应中的氧化剂是____
| 对反应3Cl2 + 8NH3== 6 NH4Cl + N 2 (1)该反应中的氧化剂是__________ ,被氧化的元素是 。 (2) 1 mol Cl2参加反应,被氧化的NH3的物质的量是 mol。 (3) 标出该反应中电子转移情况 。 (4) 若有68g NH3参加反应,电子转移的物质的量是 mol。 |
参考解答
(10分) ( 每空2分)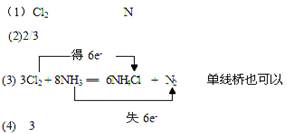 |
试题分析::(1)化合价升高元素是N,被氧化,所在反应物NH3是还原剂,化合价降低元素是Cl,所在反应物Cl2是氧化剂,被还原,故答案为:Cl2;N;(2)8个N有2个发生氧化反应,即3mol Cl2参加反应,被氧化的NH3的物质的量是2 mol,故1 mol Cl2参加反应,被氧化的NH3的物质的量是2/3mol。(4)在反应中,被氧化的物质是还原剂2mol的NH3,当有136g氨气参加反应时,只有四分之一被氧化,所以被氧化的NH3质量是68g/4=17g,即1mol,故电子转移的物质的量是3mol。 点评:本题考查学生氧化还原反应的有关知识,可以根据所学知识进行回答,难度不大。 |
相似问题
在一定条件下 RO3n-和Cl2可发生如下反应:RO3n-+Cl2+ H2O=RO42-+2Cl-+
在一定条件下,RO3n-和Cl2可发生如下反应:RO3n-+Cl2+ H2O=RO42-+2Cl-+2H+,从而可知在RO3n-中,元素R的化合价是A.+4价B.+5价C.+6价D.+7价
氮化铝(AlN)广泛应用于电子 陶瓷等工业领域。在一定条件下 AlN可在一定条件下合成:Al2O3
氮化铝(AlN)广泛应用于电子、陶瓷等工业领域。在一定条件下,AlN可在一定条件下合成:Al2O3 + N2 + 3C → 2AlN + 3CO。下列叙述正确的是()A
硫酸工厂尾气处理时用NaOH溶液吸收SO2生成NaHSO3 再用NaIO3按下列反应(配平)来制取单
硫酸工厂尾气处理时用NaOH溶液吸收SO2生成NaHSO3,再用NaIO3按下列反应(配平)来制取单质I2。NaIO3来源于自然界的矿物。 ① NaIO3 + NaHSO3— NaI
用KMnO4氧化密度为1.2 g·cm-3 溶质质量分数为36.5%的HCl溶液。反应方程式如下:2
用KMnO4氧化密度为1 2 g·cm-3,溶质质量分数为36 5%的HCl溶液。反应方程式如下:2KMnO4+16HCl===2KCl+2MnCl2+5Cl2↑+8H2O,15 8gKMnO4能使ml HCl
对于白磷引起的中毒 硫酸铜溶液是一种解毒剂 有关反应如下:1lP+15CuSO4+24H2O=5Cu
对于白磷引起的中毒,硫酸铜溶液是一种解毒剂,有关反应如下:1lP+15CuSO4+24H2O=5Cu3P+6H3PO4+15H2SO4,下列关于该反应说法错误的是:A.生成1 mo












