某体系中存在如下反应: ①H2S+4H2O-8e → SO42-+10H+ ②2IO3-+12
| 某体系中存在如下反应: ①H2S+4H2O-8e → SO42-+10H+ ②2IO3-+12 H++10e → I2+6H2O (1)反应①中H2S做__________剂,反应②属于___________ 反应(填“氧化”或“还原”)。 (2)若在反应①中失去0.2 mol 电子,则反应②中可生成 g I2。 (3)写出并配平碘酸钾与硫化氢反应的化学方程式,同时标出电子转移的方向和数目: _______________________________________________________________________。 (4)由上述反应可推知 。 a.氧化性:K2SO4> KIO3 b.酸性:HIO3> H2SO4 c.还原性:H2S > I2 d.反应过程中溶液的酸性逐渐减弱 |
参考解答
(1)还原,还原 (各1分,共2分) (2)5.08(2分) (3) 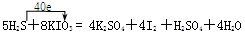 (3分,方程式2分,电子转移1分) (3分,方程式2分,电子转移1分)(4)cd(1分) |
试题分析: (1)化合价升高的反应物做还原剂,碘元素的价态由正五价,变为零价,发生还原反应。 (2)解:设生成I2的质量为x 5H2S→ 40e -→ 8 IO3-→ 4 I2 40 4*127*2 0.2 x x=5.08 (3)①*5+②*4 得5H2S+8KIO3 = 4K2SO4+4I2 +H2SO4+4H2O (4)还原性:还原剂>还原产物 ;氧化性:氧化剂>氧化产物,因为有水的生成,酸性减弱。 |
相似问题
赤铜矿的主要成分是Cu2O 辉铜矿的主要成分是Cu2S 将赤铜矿与辉铜矿按一定比例混合加热可制得铜:
赤铜矿的主要成分是Cu2O,辉铜矿的主要成分是Cu2S,将赤铜矿与辉铜矿按一定比例混合加热可制得铜:2Cu2O+Cu2S 6Cu+SO2↑。对于该反应,下列说法中正确的
已知稀硝酸与铜反应时 NO3- 一般被还原为NO;浓硝酸与铜反应时 NO3- 一般被还原为NO2。现
已知稀硝酸与铜反应时,NO3- 一般被还原为NO;浓硝酸与铜反应时,NO3- 一般被还原为NO2。现将25 6gCu投入到50mL12mol L的浓硝酸中,充分反应后,收集到
氯气在生产生活中应用广泛。实验室可用MnO2与浓盐酸反应制取 反应原理如下:MnO2+4HCl(浓)
氯气在生产生活中应用广泛。实验室可用MnO2与浓盐酸反应制取,反应原理如下:MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O(1)若制得标准状况下11.2 L Cl2,
过氧化氢(H2O2 O的化合价为-1价)俗称双氧水 医疗上利用它有杀菌消毒作用来清洗伤口。研究下列涉
过氧化氢(H2O2,O的化合价为-1价)俗称双氧水,医疗上利用它有杀菌消毒作用来清洗伤口。研究下列涉及H2O2的反应,完成下列各题:A.Ag2O+ H2O2=2Ag+O
(14分)Ⅰ 实验室常用以下方法制取氯气:MnO2+ 4HCl(浓) MnCl2+Cl2↑ + 2
(14分)Ⅰ、实验室常用以下方法制取氯气:MnO2+ 4HCl(浓) MnCl2+Cl2↑ + 2H2O,(1)用双线桥标出电子转移方向和数目。(在答题纸上标)(2)在












