(14分)Ⅰ 实验室常用以下方法制取氯气:MnO2+ 4HCl(浓) MnCl2+Cl2↑ + 2
| (14分) Ⅰ、实验室常用以下方法制取氯气:MnO2+ 4HCl(浓) 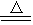 MnCl2+Cl2↑ + 2H2O, MnCl2+Cl2↑ + 2H2O,(1)用双线桥标出电子转移方向和数目。(在答题纸上标) (2)在标准状况下生成的Cl2为11.2L时,参加反应的HCl的物质的量为 , 被氧化HCl的质量为 。 Ⅱ、科学家发现,食用虾类等水生甲壳类动物的同时服用维生素C容易中毒。这是因为 对人体无害的+5价砷类化合物在维生素C的作用下,能够转化为有毒的+3价的含砷化 合物。通过以上信息填空: (1)维生素C具有 (填氧化性或还原性)。 (2)上述过程中+5价砷类物质作为 (填氧化剂或还原剂),+5价砷元素发生 反应(填氧化或还原);2mol +5价砷完全转化为 +3价砷,共转移 个 电子(用NA表示阿伏加德罗常数)。 |
参考解答
| (每空2分,共14分) Ⅰ、(1) 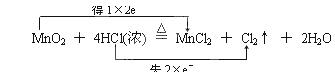 (2)2mol,36.5g。 (2)2mol,36.5g。Ⅱ、(1) 还原性 (2)氧化剂 ; 还原 ;4NA |
试题分析:Ⅰ、(1)根据反应的方程式可知,盐酸中氯元素的化合价从-1价升高到0价,失去1个电子。而二氧化锰中Mn元素的化合价从+4价降低到+2价,得到2个电子,所以根据电子到得失守恒可知,正确的表示应该是  。 。(2)氯气的物质的量是11.2L÷22.4L/mol=0.5mol,则根据反应的化学方程式可知,参加反应的氯化氢是0.5mol×4=2mol。其中被氧化的氯化氢是1mol,质量是36.5g。 Ⅱ、(1)+5价砷类化合物在维生素C的作用下,能够转化为有毒的+3价的含砷化,这说明砷元素得到电子,所以维生素C失去电子,具有还原性。 (2)As元素的化合价从+5价降低到+3价,得到2个电子,做氧化剂,则+5价砷元素发生还原反应。2mol +5价砷完全转化为 +3价砷,得到4mol电子,则共转移4NA个电子。 点评:该题是基础性试题的考查,也是高考中的常见考点,难度不大。试题放热关键是熟练掌握氧化还原反应的有关概念,判断的依据,然后再结合题意灵活分析即可。该题有利于培养学生分析问题、解决问题的能力。 |
相似问题
下列物质不能通过化合反应直接制得的是( )A.FeCl2B.NaHCO3C.Cu(OH)2D.Fe
下列物质不能通过化合反应直接制得的是( )A.FeCl2B.NaHCO3C.Cu(OH)2D.Fe(OH)3
(6分)在Cu+2H2SO4(浓)==CuSO4+SO2↑+2H2O反应中 氧化剂是_______;
(6分)在Cu+2H2SO4(浓)==CuSO4+SO2↑+2H2O反应中,氧化剂是_______;被氧化的元素是_______,每生成11 2L(标准状况)的SO2,转移的电子的物质的量为mol。
下列化学反应中 H2SO4作为氧化剂的是A.2NaOH+H2SO4=Na2SO4+2H2OB.C+2
下列化学反应中,H2SO4作为氧化剂的是A.2NaOH+H2SO4=Na2SO4+2H2OB.C+2H2SO4(浓)CO2↑+2SO2↑+2H2OC.BaCl2+H2SO4=BaSO4↓+2HClD.CuO+H2SO4=CuSO4+H2O
(8分)已知:①MnO4— +e-MnO42―(绿色)(强碱性条件)②MnO4—+ 8H+ + 5e
(8分)已知:①MnO4— +e-MnO42―(绿色)(强碱性条件)②MnO4—+ 8H+ + 5e-Mn2+(无色)+ 4H2O(强酸性条件)(1)在KOH溶液中,KMnO4与K2SO3溶液
氢化钙中的氢元素为-1价 它可用作生氢剂 反应的化学方程式是:CaH2+2H2O=Ca(OH)2+2
氢化钙中的氢元素为-1价,它可用作生氢剂,反应的化学方程式是:CaH2+2H2O=Ca(OH)2+2H2↑ ,有下列判断:①H2只是氧化产物;②H2只是还原产物;③H2O是












