氯气在生产生活中应用广泛。实验室可用MnO2与浓盐酸反应制取 反应原理如下:MnO2+4HCl(浓)
氯气在生产生活中应用广泛。实验室可用MnO2与浓盐酸反应制取,反应原理如下:MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O MnCl2+Cl2↑+2H2O(1)若制得标准状况下11.2 L Cl2,则被氧化的HCl为___________mol。 (2)多余的氯气可用NaOH溶液吸收,反应的离子方程式为__________。 (3)海底蕴藏着丰富的锰结核矿,其主要成分是MnO2。1991年由Allen等人研究,用硫酸淋洗后使用不同的方法可制备纯净的MnO2,其制备过程如下图所示: 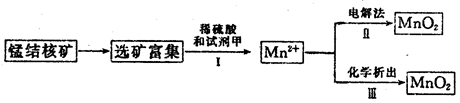 ①步骤Ⅰ中, 试剂甲必须具有的性质是____________(填序号)。 A.氧化性B.还原性C.酸性 ②步骤Ⅲ中,以NaClO3为氧化剂,当生成0.050 mol MnO2时,消耗0.10 mol·L-1的NaClO3溶液200 mL,该反应的离子方程式为___________________________。 (4)用100mL12.0 mol·L-1的浓盐酸与足量MnO2混合后,加热,反应产生的氯气物质的量远远少于0.30 mol,请你分析可能的原因为___________________________。 |
参考解答
| (每空2分,共10分) (1)1 (2)Cl2+2OH ̄=Cl ̄+ClO ̄+H2O (3)① b ②2ClO3 ̄+5Mn2++4H2O=5MnO2↓+Cl2↑+8H+ (4)随着反应的进行,盐酸浓度减小,反应终止。 |
试题分析:(1)根据化学方程式可知被氧化的HCl与Cl2的对应关系为:2HCl~Cl2,则被氧化的HCl=2n(Cl2 )=2×11.2L÷22.4L/mol=1mol。 (2)Cl2与NaOH反应生成NaCl、NaClO、H2O,进而可写成离子方程式。 (3)①步骤I中,Mn元素的化合价由+4价降低为+2价,则试剂甲应具有还原性,故答案为:b;②步骤Ⅲ中,以NaClO3为氧化剂,当生成0.050mol MnO2时,消耗0.10mol?L-1 的NaClO3溶液200mL,设还原产物中Cl的化合价为x,则由电子守恒可知,0.05mol×(4-2)=0.1mol/L×0.2L×(5-x),解得x=0,即生成氯气,则离子反应为2ClO3-+5Mn2++4H2O=5MnO2+Cl2↑+8H+。 (4)因为MnO2与浓盐酸加热才能生成Cl2,随着反应的进行,盐酸浓度减小,变为稀盐酸后反应终止。 |
相似问题
过氧化氢(H2O2 O的化合价为-1价)俗称双氧水 医疗上利用它有杀菌消毒作用来清洗伤口。研究下列涉
过氧化氢(H2O2,O的化合价为-1价)俗称双氧水,医疗上利用它有杀菌消毒作用来清洗伤口。研究下列涉及H2O2的反应,完成下列各题:A.Ag2O+ H2O2=2Ag+O
(14分)Ⅰ 实验室常用以下方法制取氯气:MnO2+ 4HCl(浓) MnCl2+Cl2↑ + 2
(14分)Ⅰ、实验室常用以下方法制取氯气:MnO2+ 4HCl(浓) MnCl2+Cl2↑ + 2H2O,(1)用双线桥标出电子转移方向和数目。(在答题纸上标)(2)在
下列物质不能通过化合反应直接制得的是( )A.FeCl2B.NaHCO3C.Cu(OH)2D.Fe
下列物质不能通过化合反应直接制得的是( )A.FeCl2B.NaHCO3C.Cu(OH)2D.Fe(OH)3
(6分)在Cu+2H2SO4(浓)==CuSO4+SO2↑+2H2O反应中 氧化剂是_______;
(6分)在Cu+2H2SO4(浓)==CuSO4+SO2↑+2H2O反应中,氧化剂是_______;被氧化的元素是_______,每生成11 2L(标准状况)的SO2,转移的电子的物质的量为mol。
下列化学反应中 H2SO4作为氧化剂的是A.2NaOH+H2SO4=Na2SO4+2H2OB.C+2
下列化学反应中,H2SO4作为氧化剂的是A.2NaOH+H2SO4=Na2SO4+2H2OB.C+2H2SO4(浓)CO2↑+2SO2↑+2H2OC.BaCl2+H2SO4=BaSO4↓+2HClD.CuO+H2SO4=CuSO4+H2O












