已知稀硝酸与铜反应时 NO3- 一般被还原为NO;浓硝酸与铜反应时 NO3- 一般被还原为NO2。现
| 已知稀硝酸与铜反应时,NO3- 一般被还原为NO;浓硝酸与铜反应时,NO3- 一般被还原为NO2。现将25.6gCu投入到50mL12mol/L的浓硝酸中,充分反应后,收集到4.48L(标况)NO和NO2的混合气体。 (1)写出铜分别与浓硝酸和稀硝酸反应的化学方程式:______________________________________________________________; _______________________________________________________________。 (2)被还原的硝酸的物质的量为:____________ (3)25.6gCu与50mL12mol/L的浓硝酸反应后,剩余物为:____________,其物质的量为:____________。 |
参考解答
| (1)Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O 3Cu+8HNO3(稀)=3 Cu(NO3)2+2NO↑+4H2O (2)0.2mol (3)铜; 0.2mol |
试题分析:(1)硝酸具有强氧化性,和金属铜反应的化学方程式分别是Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O、3Cu+8HNO3(稀)=3 Cu(NO3)2+2NO↑+4H2O。 (2)硝酸被还原生成NO或NO2,所以被还原的硝酸的物质的量就是生成的混合气的物质的量,即 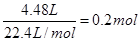 。 。(3)根据(2)可知,没有被还原的硝酸的物质的量是 0.05L×12mol/L-0.2mol=0.4mol 25.6g铜的物质的量是25.6g÷64g/mol=0.4mol 如果铜完全反应则应该生成0.4mol硝酸铜 则没有被还原的硝酸的物质的量就是0.8mol>0.4mol 这说明反应中硝酸是不足的,铜过量 应该生成硝酸铜的物质的量是0.4mol÷2-0.2mol=0.2mol 所以过量的铜的物质的量是0.4mol-0.2mol=0.2mol 点评:该题是属于中等难度的计算题,本题的关键是学会利用好各种守恒法解题,化学计算中常用的守恒法包括质量守恒定律、原子守恒、电子的得失守恒以及电荷守恒等,需要学生在平时的训练注意总结、归纳和积累。 |
相似问题
氯气在生产生活中应用广泛。实验室可用MnO2与浓盐酸反应制取 反应原理如下:MnO2+4HCl(浓)
氯气在生产生活中应用广泛。实验室可用MnO2与浓盐酸反应制取,反应原理如下:MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O(1)若制得标准状况下11.2 L Cl2,
过氧化氢(H2O2 O的化合价为-1价)俗称双氧水 医疗上利用它有杀菌消毒作用来清洗伤口。研究下列涉
过氧化氢(H2O2,O的化合价为-1价)俗称双氧水,医疗上利用它有杀菌消毒作用来清洗伤口。研究下列涉及H2O2的反应,完成下列各题:A.Ag2O+ H2O2=2Ag+O
(14分)Ⅰ 实验室常用以下方法制取氯气:MnO2+ 4HCl(浓) MnCl2+Cl2↑ + 2
(14分)Ⅰ、实验室常用以下方法制取氯气:MnO2+ 4HCl(浓) MnCl2+Cl2↑ + 2H2O,(1)用双线桥标出电子转移方向和数目。(在答题纸上标)(2)在
下列物质不能通过化合反应直接制得的是( )A.FeCl2B.NaHCO3C.Cu(OH)2D.Fe
下列物质不能通过化合反应直接制得的是( )A.FeCl2B.NaHCO3C.Cu(OH)2D.Fe(OH)3
(6分)在Cu+2H2SO4(浓)==CuSO4+SO2↑+2H2O反应中 氧化剂是_______;
(6分)在Cu+2H2SO4(浓)==CuSO4+SO2↑+2H2O反应中,氧化剂是_______;被氧化的元素是_______,每生成11 2L(标准状况)的SO2,转移的电子的物质的量为mol。












