已知A B C D E F为元素周期表中原子序数依次增大的前20号元素 A B与C;D E与F分别位
| 已知A、B、C、D、E、F为元素周期表中原子序数依次增大的前20号元素,A、B与C;D、E与F分别位于同一周期。A原子L层上有3个未成对电子,B的简单负二价离子与C原子核外电子排布相同、含有D元素的盐的焰色反应火焰为黄色,EF3是由活泼金属和活泼非金属组成的共价化合物,G有多种氧化物,其中一种氧化物有磁性,填写下列空白 (1)元素的第一电离能最大的是________,属于过渡元素的是________(填写元素符号) (2)写出B元素的基态原子价电子排布式__________________,F离子电子排布式_________________。 (3)AF3分子中A原子的杂化类型是________,AF3分子的几何构型为___________。 (4)已知E2B3的晶格比DF的晶格能大得多,试分析导致两者晶格能差异的主要原因是:________________________________________________________。 (5)构成G晶体的微粒是________,G的晶胞结构如下图甲所示,G的晶胞为________结构。若G原子的半径为1.27×10-10 m,G金属晶体中的晶胞长度,即下图乙中AB的长度为________m。 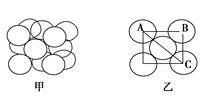 |
参考解答
| (1)Ne Fe (2)2s22p4 1s22s22p63s23p6 (3)sp3 三角锥形 (4)Al2O3晶体中Al3+、O2-的带电荷大于NaCl晶体中Na+、Cl-的带电荷 (5)金属阳离子、自由电子 面心立方 3.59×10-10 |
| 由题干知道,这几种元素分别是A(氮)、B(氧)、C(氖)、D(钠)、E(铝)、F(氯)、G(铁)。 (1)氖原子是最外层为8电子稳定结构,不易失去电子,所以氖的第一电离能最大。 (2)O元素的基态原子价电子排布式是2s22p4;Cl-的电子排布式是1s22s22p63s23p6; (3)NCl3中N采取sp3杂化,其中一个杂化轨道上有一对电子,不参与成键,另外三个杂化轨道分别与三个Cl形成σ键,由于一对孤对电子的存在,三个Cl不可能平均瓜分N周围的空间,而是被孤对电子排斥到一侧,形成三角锥形结构。 (4)Al2O3晶体的晶格能大于NaCl晶体的晶格能的主要原因是Al2O3晶体中Al3+、O2-的电荷大于NaCl晶体中Na+、Cl-的电荷;次要原因是离子半径。 (5) AB2+BC2=AC2且AB=BC AB2= 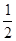 ×(4×1.27×10-10)2 ×(4×1.27×10-10)2AB=3.59×10-10 |
相似问题
已知1~18号元素的离子aW3+ bX+ cY2- dZ- 都具有相同的电子层结构 下列关系正确的是
已知1~18号元素的离子aW3+、bX+、cY2-、dZ- 都具有相同的电子层结构,下列关系正确的是A.质子数:c>bB.离子的还原性:Y2->Z-C.氢化物的稳定性:H2Y
下列说法中错误的是 A.SO2 SO3都是极性分子B.在NH4+和[Cu(NH3)4]2+中都存在配
下列说法中错误的是 A.SO2、SO3都是极性分子B.在NH4+和[Cu(NH3)4]2+中都存在配位键C.元素电负性越大的原子,吸引电子的能力越强 D.PCl3和NF3分子
(双选)某元素X的原子序数为52 下列叙述正确的是( )。A.X的主要化合价是-2 +4 +6B.
(双选)某元素X的原子序数为52,下列叙述正确的是( )。A.X的主要化合价是-2、+4、+6B.X可以形成稳定的气态氢化物C.X的最高价氧化物对应水化物的酸性
(16分)已知A B C D E F G和H都是元素周期表中前36号的元素 它们的原子序数依次增大。
(16分)已知A、B、C、D、E、F、G和H都是元素周期表中前36号的元素,它们的原子序数依次增大。A是周期表中原子半径最小的元素,B原子最外层电子数是内层
下列三种微粒可以归为一类 请选择一项可以归入此类的结构示意图( )。A.B.C.D.
下列三种微粒可以归为一类,请选择一项可以归入此类的结构示意图( )。A.B.C.D.












