(16分)已知A B C D E F G和H都是元素周期表中前36号的元素 它们的原子序数依次增大。
| (16分)已知A、B、C、D、E、F、G和H都是元素周期表中前36号的元素,它们的原子序数依次增大。A是周期表中原子半径最小的元素,B原子最外层电子数是内层电子数的两倍,C的基态原子核外有7种不同运动状态的电子,E是电负性最大的元素,F的氢化物和最高价氧化物对应的水化物均为强酸,G、H分别是周期表中1—18纵列中的第10、12纵列元素。请回答下列问题: (1)D元素在周期表位置是 ,G的核外价层电子排布式为 。 (2)E与A形成的化合物比F与A形成的化合物的沸点 (填“高”或“低”),其原因是 。 (3)B、C原子的第一电离能较大的是 (填元素符号),其原因是 。 (4)BD32-离子中B原子采取 杂化,任写一种与BD互为等电子体的分子的电子式 。 (5)元素H的一种硫化物晶体的晶胞结构如图所示,该硫化物的化学式是 。元素H的氢氧化物可溶于氨水中,生成和铜氨配离子相同配位数的离子,写出该反应的离子方程式为 。 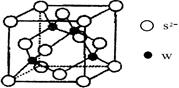 |
参考解答
| (1)第二周期,第VIA族(2分),3d84s2(2分)。 (2)高(1分),HF分子间存在氢键(1分)。 (3)N(1分),N原子的p轨道是半充满状态(1分)。
(5)ZnS(2分)。 Zn(OH)2+4NH3='[' Zn (NH3)42++2OH-(2分)。 |
试题分析:根据题意知,A、B、C、D、E、F、G和H都是元素周期表中前36号的元素,它们的原子序数依次增大。A是周期表中原子半径最小的元素,则A为氢元素;B原子最外层电子数是内层电子数的两倍,则B为碳元素;C的基态原子核外有7种不同运动状态的电子,则C为氮元素;E是电负性最大的元素,则E为氟元素;又它们的原子序数依次增大,则D为氧元素;F的氢化物和最高价氧化物对应的水化物均为强酸,则F为氯元素;G、H分别是周期表中1—18纵列中的第10、12纵列元素,则G为镍元素,H为锌元素。(1)D为氧元素,在周期表位置是第二周期,第VIA族;,G为28号元素镍元素,核外价层电子排布式为3d84s2;(2)HF比HCl的沸点高,其原因是HF分子间存在氢键;(3)C、N原子的第一电离能较大的是N,其原因是N原子的p轨道是半充满状态,较稳定;(4)根据价层电子对互斥理论判断,CO32-离子中C原子采取sp2杂化,根据等电子体的概念判断,与CO互为等电子体的分子为N2,电子式见答案。(5)根据锌的硫化物晶体的晶胞结构,利用切割法判断,该硫化物的化学式是ZnS。元素锌的氢氧化物可溶于氨水中,生成和铜氨配离子相同配位数的离子,该反应的离子方程式为Zn(OH)2+4NH3='[' Zn (NH3)42++2OH-。 |
相似问题
下列三种微粒可以归为一类 请选择一项可以归入此类的结构示意图( )。A.B.C.D.
下列三种微粒可以归为一类,请选择一项可以归入此类的结构示意图( )。A.B.C.D.
D E X Y Z是周期表中的前20号元素 且原子序数逐渐增大 它们的最简氢化物分子的空间构型依次是
D、E、X、Y、Z是周期表中的前20号元素,且原子序数逐渐增大,它们的最简氢化物分子的空间构型依次是正四面体形、三角锥形、正四面体形、角形(V形)、直线
A B C D四种短周期元素 原子序数依次增大 A原子的最外层上有4个电子;B的阴离子和C的阳离子具
A、B、C、D四种短周期元素,原子序数依次增大,A原子的最外层上有4个电子;B的阴离子和C的阳离子具有相同的电子层结构,两元素的单质反应,能生成一种淡
元素周期表是元素周期律的具体表现形式。下列说法正确的是A.元素的原子结构决定了元素在周期表中的位置B
元素周期表是元素周期律的具体表现形式。下列说法正确的是A.元素的原子结构决定了元素在周期表中的位置B.短周期是指第一、二周期C.第ⅠA元素全部是金
下列各组中的性质比较 不正确的是( )A.稳定性:NH3<PH3<SiH4B.酸性:HClO4>H
下列各组中的性质比较,不正确的是()A.稳定性:NH3<PH3<SiH4B.酸性:HClO4>H2SO4>H3PO4C.碱性:KOH>NaOH>Mg(OH)2D.还原性:F-<Cl-<Br-












