利用化学原理对工厂排放的废水 废渣等进行有效检测与合理处理。(一)染料工业排放的废水中含有大量有毒的
| 利用化学原理对工厂排放的废水、废渣等进行有效检测与合理处理。 (一)染料工业排放的废水中含有大量有毒的NO2-,可以在碱性条件下加入铝粉除去(加热处理后的废水会产生能使湿润的红色石蕊试纸变蓝的气体)。除去NO2-的离子方程式为________。 (二)某工厂对制革工业污泥中Cr(Ⅲ)回收与再利用工艺如下(硫酸浸取液中金属离子主要是Cr3+,其次是Fe3+、Fe2+、Al3+、Ca2+、Mg2+): 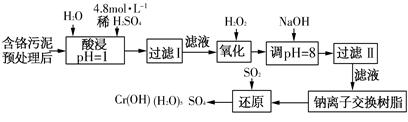 常温下部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
(1)酸浸时,为了提高浸取率可采取的措施是________(至少写一条)。 (2)调pH=8是为了除去________(填Fe3+、Al3+、Ca2+、Mg2+)。 (3)钠离子交换树脂的原理为Mn++nNaR→MRn+nNa+,被交换的杂质离子是________(填Fe3+、Al3+、Ca2+、Mg2+)。 (4)试配平氧化还原反应方程式:□Na2Cr2O7+□SO2+□H2O = □Cr(OH)(H2O)5SO4+□Na2SO4;每生成1mol Cr(OH)(H2O)5SO4消耗SO2的物质的量为________。 (三)印刷电路铜板腐蚀剂常用FeCl3。腐蚀铜板后的混合浊液中,若Cu2+、Fe3+和Fe2+的浓度均为0.10mol·L-1,请参照上表给出的数据和提供的药品,简述除去CuCl2溶液中Fe3+和Fe2+的实验步骤:①________;②________;③过滤。(提供的药品:Cl2、浓H2SO4、NaOH溶液、CuO、Cu)。 |
参考解答
| (15分) (一)2Al+OH-+NO2-+2H2O===2AlO2-+NH3·H2O (二)(1)升高温度、搅拌、过滤后再向滤渣中加入硫酸(多次浸取)、适当延长浸取时间(只要答出任意一点即可,其他合理答案也可) (2)Fe3+、Al3+ (3)Mg2+、Ca2+ (4)1 3 11 2 1 1.5mol (三)①通入足量氯气将Fe2+氧化成Fe3+ ②加入CuO调节溶液的pH至3.2~4.7 |
试题分析:(一) 加热处理后的废水会产生能使湿润的红色石蕊试纸变蓝的气体,说明氮的还原产物为NH3, 除去NO2-的离子方程式为:2Al+OH-+NO2-+2H2O===2AlO2-+NH3·H2O,答案为:2Al+OH-+NO2-+2H2O===2AlO2-+NH3·H2O; (二)(1) 酸浸时,为了提高浸取率可采取的措施可以从温度、浓度、时间、改变反应物粒子大小等角度去答。答案为:升高温度、搅拌、过滤后再向滤渣中加入硫酸(多次浸取)、适当延长浸取时间(只要答出任意一点即可,其他合理答案也可); ⑵从表中看出,pH小于8时Fe3+(3.2)、Al3+(8)均沉淀完全,答案:Fe3+、Al3+; ⑶Fe3+、Al3+已经沉淀,溶液中还有Ca2+、Mg2+,用离子交换树脂除去,答案:Ca2+、Mg2+; ⑷用化合价升降法或电子守恒配平方程式: 1 Na2Cr2O7+ 3 SO2+ 11 H2O = 2 Cr(OH)(H2O)5SO4+ 1 Na2SO4,由方程式每生成1mol Cr(OH)(H2O)5SO4消耗SO2的物质的量为1.5mol,答案:1 3 11 2 1 1.5mol (三)Fe2+ 在PH=9.0时才沉淀完全,而此时Cu2+ 已经沉淀,所以要能Cl2将Fe2+ 氧化成Fe3+ ,然后加CuO或Cu (OH)2或Cu2(OH)2CO3调节PH至3.2~4.7。答案:①通入足量氯气将Fe2+氧化成Fe3+ ②加入CuO调节溶液的pH至3.2~4.7。3+ 等常见离子的性质和除杂等基础知识,中等难度。 |
相似问题
高锰酸钾(KMnO4)是一种常用的氧化剂。I.(1)有下列变化: 找出其中一个变化与“”组成一个反应
高锰酸钾(KMnO4)是一种常用的氧化剂。I.(1)有下列变化:,找出其中一个变化与“”组成一个反应,写出该反应的离子方程式____。(2)不同条件下高锰
氮及其化合物与我们的吃 穿 住 行 健康等都有着密切的联系 也是高中化学学习中重要的一部分。请回答下
氮及其化合物与我们的吃、穿、住、行、健康等都有着密切的联系,也是高中化学学习中重要的一部分。请回答下列问题:I.(1)现有一支15mL的试管,充满NO
(8分)稀HNO3和锌反应的化学方程式如下:4Zn + 10 HNO3= 4Zn(NO3)2 +N2
(8分)稀HNO3和锌反应的化学方程式如下:4Zn + 10 HNO3= 4Zn(NO3)2 +N2O↑+5H2O (1)请标明上述化学方程式中电子转移的方向和数目。(2)该反应中还原
高锰酸钾可用于除去地下水的硫化氢异味的原理是生成的硫和二氧化锰等沉淀物可过滤除去。水体呈弱酸性时 高
高锰酸钾可用于除去地下水的硫化氢异味的原理是生成的硫和二氧化锰等沉淀物可过滤除去。水体呈弱酸性时,高锰酸钾的还原产物是MnO和MnO2,且MnO和MnO2的
标准状况下 将a L SO2和Cl2组成的混合气体通入100 mL 0.2 mol·L-1Fe2(S
标准状况下,将a L SO2和Cl2组成的混合气体通入100 mL 0 2 mol·L-1Fe2(SO4)3溶液中,充分反应后,溶液的棕黄色变浅。向反应后的溶液中加入足量的B












